Diviser la prise hebdomadaire du méthotrexate en 2 prises le même jour : une étude clinique réalisée en Inde
Le méthotrexate (MTX) reste la pierre angulaire du traitement de fond de la polyarthrite rhumatoïde (PR). Il peut être utilisé par voie orale ou par voie sous-cutanée (SC) (dont le coût financier est bien plus élevé). L’absorption du MTX par voie orale est un phénomène en partie saturable quand la dose dépasse 15 mg, aboutissant à des taux sériques inférieures à ceux de la voie SC. Il a été proposé de fractionner la dose hebdomadaire du MTX peros en 2 prises dans la même journée (matin et soir). Afin d’explorer l’intérêt clinique (et financier) d’un tel fractionnement, des équipes indiennes [C. Bhushan Prasad. Abstract 1583] ont réalisé un essai thérapeutique sur une période de 24 semaines, comparant deux méthodesde prise orale d’une dose hebdomadaire de 25 mg de MTX : prise unique (25 mg) et prise fractionnée (10 mg le matin et 15 mg le soir le même jour). Dans cette étude randomisée (1:1), en simple insu, ont été inclus 253 patients atteints d’une PR séropositive, évoluant depuis moins de 5 ans, n’ayant pas de reçu de traitement de fond en dehors de l’hydroxychloroquine et ayant une maladie cliniquement active (DAS28-VS moyen 6,5). À la semaine 16, l’activité de la PR était significativement inférieure dans le groupe traité par une dose fractionnée de MTX par rapport à celui traité par une dose unique : bonne réponse EULAR chez 22 % vs 10 % (p=0,007) ; réponse ACR50 chez 55 % vs 35% (p=0,002).
Toutefois, le score HAQ n’était pas différent. À partir de S16, chez les patients insuffisamment répondeurs au MTX, un autre traitement de fond conventionnel pouvait être associé au MTX : sulfasalazine ou léflunomide. Ceci a été le cas chez 55 % des patients dans le groupe prise unique et 35 % dans le groupe prise fractionnée.
À la semaine 24, la différence observée à S16 avait presque disparue et la seule différence significative en faveur de la prise fractionnée était la valeur du DAS28 (4,1 vs 4,5 ; p=0,03). Sur le plan de la tolérance, les seules différences étaient un pourcentage plus élevé de cytolyse hépatique et de nausées dans le groupe prise fractionnée, a priori en relation avec des taux sériques plusélevés. Ces résultats ne nous semblent pas être négatifs, même si l’objectif initial était de démontrer une différence significative dans la réponse EULAR à S24. L’association plus fréquente d’un autre traitement de fond conventionnel à S16 chez les patients du groupe prise unique vient perturber l’interprétation à S24. L’étude semble démontrer l’intérêt d’une prise fractionnée du MTX, pour cette posologie de 25 mg,chez certains patients dont l’identification n’est cependant pas possible. Elle ne démontre pas l’intérêt de switcher de la prise unique à la prise fractionnée chez des patients insuffisamment répondeurs à une prise unique. Cette problématique ne concerne en théorie que des posologies supérieures à 15 mg/ semaine.
Déformations d’une main de polyarthrite rhumatoïde
 |
Les anti-TNF jouent-ils un rôle aggravant dans l’atteinte pulmonaire interstitielle de la polyarthrite rhumatoïde ?
Une étude rétrospective observationnelle américaine Depuis plusieurs années, les rhumatologues se méfient des anti-TNF chez les patients ayant une pneumopathie interstitielle diffuse (PID) associée à la PR, ceci sur la foi de publications faisant état d’une aggravation de la PID sous anti-TNF, mais sans qu’il y ait eu d’étude prospective randomisée. Chez ces patients, l’habitude a souvent été prise de privilégier le rituximab et l’abatacept. Mais le doute persiste et c’est tout l’intérêt de l’étude pharmaco-épidémiologique menée aux Etats-Unis à partir de la base de données de l’administration des vétérans américains [B. England. Abstract 1582].
Pour cette étude ont été sélectionnés les patients atteints de PR avec une PID, débutant un traitement de fond par un anti-TNF (groupe 1), ou par un autre traitement biologique/JAKi (groupe 2) au cours des années 2006 à 2018. À partir des 1 046 patients répondant aux critères d’éligibilité, ont été formés par un score de propension (faisant intervenir de nombreux facteurs dont la CVF initiale) deux groupes réellement comparables de 237 patients chacun. Dans le groupe 1, les principaux anti-TNF étaient adalimumab (51 %) et étanercept (37 %). Dans le groupe 2, les principaux traitements étaient rituximab (53 %) et abatacept (28 %). Le critère principal de jugement était un score composite associant hospitalisation pour cause respiratoire et décès. Ce critère était analysé dans les 3 années suivant le début du traitement.
Les résultats montrent qu’il n’y a aucune différence significative entre les 2 groupes de traitement tout au long du suivi de 3 ans, que ce soit pour le score composite, pour l’hospitalisation pour cause respiratoire ou pour le décès (d’un point de vue numérique, l’avantage est même aux anti-TNF). Ces résultats d’une étude bien menée vont contre l’attitude qui vise à écarter systématiquement les anti-TNF chez les patients atteints d’une PR avec PID.
Effet du traitement par abatacept dans la pré-PR symptomatique mais sans arthrite
Le diagnostic précoce et le traitement précoce est un enjeu majeur des maladies chroniques notamment inflammatoires. La PR séropositive, définie avec la présence d’arthrites cliniques et d’auto-anticorps (ACPA et/ou facteur rhumatoïde), est souvent précédée de plusieurs années par l’apparition des autoanticorps et parfois précédée d’une phase clinique faite d’arthralgies sans arthrite clinique. Il existe donc une phase « préclinique » de la PR, au sens où il n’y a pas d’arthrite mais où il peut y avoir des arthralgies inflammatoires. Certains traitements de fond de la PR font l’objet d’essais thérapeutiques dont le but est de rechercher si le traitement prescrit lors de cette phase « préclinique » peut retarder l’apparition de la phase « clinique » c’est-à-dire d’une véritable PR définie par l’apparition des arthrites.
L’étude internationale appelée APIPPRA est un essai randomisé de phase IIB, comparant l’abatacept (ABA) avec le placebo (PBO) chez des patients ayant cliniquement des arthralgies inflammatoires sans arthrites et des auto-anticorps anti- CCP et/ou facteur rhumatoïde (FR) [A. Cope ; Abstract 0835]. L’étude a été réalisée sur 2 ans et comprend 2 phases : une phase de traitement (ABA vs PBO) pendant un an et une phase de suivi (sans traitement) pendant l’année suivante. Le critère principal de l’étude est l’apparition d’au moins 3 arthrites cliniques ou d’une PR définie par les critères ACR/EULAR 2010.
Dans cette étude ont été inclus 213 patients (103 PBO, 110 ABA), d’âge moyen 49 ans. Il est notable que 73 % des patients avaient une discrète synovite échographique en mode B, mais doppler négative. Le résultat est montré dans la figure 1.
Figure 1. Étude APPIPRA : taux de non-apparition d’une PR chez des patients pré-PR traités parabatacept ou placebo pendant la première année [Abstract 0835].

Après un an de traitement, il y a une importante différence entre les 2 groupes, puisqu’une polyarthrite s’est développée chez 29 % des patients sous PBO et seulement 6 % sous ABA. Mais cette différence s’annule presque à 2 ans, c’est-à-dire une année après l’arrêt du traitement. Les scores douleur et fonction sont améliorés au cours de la première année, c’est-à-dire sous traitement. Si l’objectif de l’étude n’est pas atteint dans la population de l’étude, c’est-à-dire que le traitement par ABA pendant une année ne protège pas réellement contre l’apparition de la polyarthrite au cours de l’année suivante, cet objectif est en revanche atteint dans la sous-population de l’étude ayant les taux les plus élevés d’ACPA. Rappelons ici que le mode d’action de l’ABA est cellulaire, inhibant (au moins théoriquement) indirectement la production d’auto-anticorps. Il semble donc que l’ABA ait un effet préventif du développement de la PR dans une sous-population de pré-PR défini par des taux très élevés d’ACPA. Cette constatation a un intérêt théorique pour le développement des stratégies thérapeutiques dans la pré-PR.
La neuro-immunologie et la polyarthrite rhumatoïde
Le nerf vague (ou nerf pneumogastrique) est un nerf mixte avec un fort contingent végétatif parasympathique qui constitue la Xe paire crânienne. Son trajet, qui part du tronc cérébral au niveau du bulbe, s’étend a de multiples organes vitaux dans le thorax (coeur et poumon, surtout le nerf vague droit) et l’abdomen (surtout le nerf vague gauche) où il innerve notamment l’estomac, la rate et les intestins. Il a été montré depuis les années 1990 que le nerf vague joue un rôle important dans la neuro-immunologie par le biais de voies sensitives afférentes et efférentes. En particulier, la partie efférente du nerf vague (donc le système parasympathique) a une action anti-inflammatoire systémique que l’on appelle la voie cholinergique anti-inflammatoire [Kelly MJ. Cell Rep Med 2022 ; 3 : 100696].
L’acétylcholine (ACh) constitue le neurotransmetteur clé du système parasympathique et il a été démontré à partir des études chez l’animal que le nerf vague module la réponse TNF alpha (à une infection) des macrophages de la rate par l’intermédiaire d’un sous-type de récepteur à l’ACh dénommé alpha7nAChR et présent notamment à la surface des macrophages. Rappelons qu’il existe un nerf vague de chaque côté et que son trajet passe par le cou (accolé à la carotide) et le médiastin. Dans les modèles animaux d’arthrite expérimentale, il a été montré que l’activation de la voie cholinergique anti-inflammatoire par voie chimique améliore l’arthrite. Cette voie est une cible possible de traitements de la PR, que ce soit par voie chimique ou mécanique. Pour démontrer un rôle du nerf vague dans la PR, une équipe danoise a réalisé une étude nationale rétrospective à partir des registres nationaux de codage pour la période 1977-1995 [M. Baker. Abstract 0836].L’objectif de cette étude était de définir si la vagotomie (réalisée dans le cadre du traitement de l’ulcère gastrique réfractaire) favorise la survenue d’une PR. Il existe 3 types devagotomie : tronculaire, sélective (respect de la branche coeliaque) et supra-sélective (ne touchant que les branches gastriques). L’analyse a donc comparé le risque de survenue, d’une part de la PR, et d’autre part de l’arthrose (et plus spécifiquement des prothèses totales de hanche et de genou) dans 2 types de populations appariés (échantillons de la population générale) :
• Comparaisons 1 : 2 260 patients ayant eu une vagotomie tronculaire et 22 610 témoins appariés.
• Comparaisons 2 : 3 810 patients ayant eu une vagotomie supra-sélectiveet 38 090 témoins appariés.
Les hazard ratios (HR ; risque des patients par rapport aux témoins) après ajustements sont présentés au tableau I. Il est bien démontré que seule la vagotomie tronculaire (et donc touchant la rate), et non la vagotomie supra-sélective, favorise la survenue d’une PR (et non d’une arthrose) avec un risque relatif d’environ 2,5. Il faut garder en mémoire que la vagotomie tronculaire, contrairement à la vagotomie suprasélective, a des conséquences sur le tractus intestinal et donc potentiellement sur le microbiote intestinal. Dans un article suédois publié en 2020, il avait été montré que la vagotomie augmente le risque de maladie inflammatoire colo-intestinale, et particulièrement de la maladie de Crohn où le risque est multiplié par 3 en cas de vagotomie tronculaire
[Liu B. Aliment Pharmacol Ther 2020 ;51 : 1022-1030].
La stimulation électrique du nerf vague est essayée dans de nombreuses pathologies. Elle peut se faire par un stimulateur implantable chirurgicalement ou par voie transcutanée non invasive, notamment par stimulation du rameau auriculaire purement sensitif sur la peau de l’oreille externe (du côté gauche pour la stimulation d’un organe sous-diaphragmatique, ou stimulation bilatérale). Plusieurs études de la stimulation non invasive du nerf vague chez des patients atteints de PR ont été publiées, suggérant un effet favorable sur la PR, mais il s’agit d’essais de faibles effectifs et/ou non contrôlés.
Tableau I. Risque relatif mesuré par le hazard ratio (HR) de survenue d’une polyarthrite rhumatoïde ou d’une arthrose, chez des patients ayant subi une vagotomie par rapport à des témoins appariés [Abstract 0836].
| Vagotomie tronculaire | Vagotomie supra-sélective | |
| Polyarthrite rhumatoïde | HR=2,62 (IC95% 1,47-4,67) |
HR=1,05 (IC95% 0,51-2,17) |
| Arthrose | HR=1,23 (IC95% 0,86-1,78) |
HR=1,01 (IC95% 0,70-1,45) |
Une étude randomisée en double aveugle a été réalisée et rapportée à l’ACR par Matthew Baker [M. Baker. Abstract 0837]. Ce sont 113 patients atteints d’une PR active (score DAS28-CRP=5) malgré un traitement de fond conventionnel qui ont été randomisés entre un traitement actif (stimulation vagale auriculaire gauche ou bilatérale, pendant 15 minutes par jour) et une procédure placebo (fausse stimulation vagale avec le même appareillage).
L’objectif principal était le taux de réponse ACR20 à la semaine 12. Parmi les patients inclus, 101 ont terminé les 12 semaines de l’étude. La figure 2 montre qu’il n’y a pas de différence significative des taux deréponse ACR20, ACR50 et ACR70, entre les patients traités par stimulation vagale uni ou bilatérale et ceux traités par une procédure placebo. De la même façon, aucun critère de jugement secondaire n’a montré une supériorité de la stimulation effective du nerf vague. La question reste posée : la durée quotidienne (15 mn) de stimulation transcutanée du nerf vague choisie dans cette étude est-elle la bonne pour obtenir un effet biologique ? À noter toutefois que des effets secondaires indésirables ont été notés 2 fois plus souvent chez les patients traités par stimulation versus ceux ayant eu la procédure placebo.
Figure 2. Taux de réponse ACR20, ACR50 et ACR70 chez des patients atteints de polyarthrite rhumatoïde traités par stimulation auriculaire unilatérale ou bilatérale du nerf vague, ou par une procédure placebo (sham) [Abstract 0837].

Atteinte destructrice de l’épaule due à la polyarthrite rhumatoïde.
 |
Nouvelles perspectives thérapeutiques de la maladie de Sjögren
Aucun traitement de fond n’a fait la preuve de son efficacité dans le traitement du syndrome de Gougerot- Sjögren primitif maintenant dénommé maladie de Sjögren.
Il existe deux scores d’évaluation de l’activité de la maladie de Sjögren :
• Le score ESSPRI qui évalue les 3 signes de la triade symptomatique habituelle de la maladie de Sjögren : sécheresse, fatigue, douleur.
• Le score ESSDAI qui évalue l’atteinte systémique de la maladie de Sjögren, en évaluant 12 domaines (dix cliniques et 2 biologiques).
Deux essais cliniques ont été rapportés à l’ACR qui visent tous deux une même cible, le couple CD40- CD40L. La liaison entre le CD40 ligand (CD40L), présent à la surface des lymphocytes T activés par l’antigène, et le CD40 présent à la surface les lymphocytes B est un des systèmes majeurs de costimulation dans l’interaction lymphocytaire T-B. Cette liaison intervient en stimulant la formation des centres germinatifs, la prolifération et la différenciation des lymphocytes B activés (par le lymphocyte T), la commutation isotypique qui permet la sécrétion des IgG et IgA spécifiques et la sécrétion de cytokines (IL-6) par le lymphocyte B. Il s’agit de l’une des cibles thérapeutiques des nouveaux traitements en développement dans la maladie de Sjögren. L’essai thérapeutique de phase 2b (TWINSS) rapporté par Benjamin Fisher et coll. [BA Fisher. Abstract1634] concerne l’iscalimab (ISC) qui est un anticorps monoclonal dirigé contre le CD40. Il s’agit d’une étude randomisée contre placebo (PBO) d’une durée de 24 semaines comparant l’ISC en injection sous-cutanée toutes les 2 semaines et le PBO.
Cette étude comporte 2 cohortes différentes :
• Cohorte 1 (173 patients) dite systémique : patients avec un score ESSPRI ≥ 5 et un score ESSDAI ≥ 5.
Il y a 3 dosages d’ISC : 150 mg, 300 mg et 600 mg.
• Cohorte 2 (100 patients) dite symptomatique : patients avec ESSPRI ≥ 5 mais ESSDAI < 5. Il y a un seul dosage d’ISC à 600 mg.
Les critères d’évaluation sont les variations des scores ESSPRI (cohorte 2) et ESSDAI (cohorte 1) entre S0 et S24. Dans la cohorte 2, il y a une différence numérique mais non significative en faveur de l’ISC vs PBO sur le score ESSPRI, avec une amélioration significative pour la sécheresse (et aussi pour la mesure du flux salivaire) mais pas pour la douleur. Le même type de résultat pour le score ESSPRI est retrouvé dans la cohorte 1.
Dans cette cohorte 1, il y a une amélioration significativement supérieure du score ESSDAI dans les groupes ISC 150 mg et 600 mg (et tendance pour le 300 mg). Les résultats complets d’un autre essai thérapeutique de phase 2, impliquant un récepteur soluble de l’antagoniste du CD40L, ont étémontré [EW St. Clair. Abstract 1636].
Pneumopathie interstitielle diffuse de type PIC en relation avec une polyarthrite rhumatoïde.

Comme l’ISC, cette molécule appelée dazodalibep (DAZ) inhibe la costimulation lymphocytaire T-B. Il s’agit d’un essai randomisé en double aveugle vs BPO réalisé d’une part chez 74 patients ayant une maladie de Sjögren active sur le plan systémique (ESSDAI ≥ 5), et d’autre part chez 109 patients ayant une maladie active sur le plan symptomatique (ESSPRI ≥ 5, mais ESDAI < 5). La procédure du DAZ est la suivante : perfusion intraveineuse d’une dose de 1500 mg toutes les 2 semaines en traitement d’attaque, puis toutes les 4 semaines. L’étude comporte 2 phases : phase 1 avec évaluation à J169 ; phase 2 qui est un cross over où les patients changent de bras thérapeutique avec évaluation à J365.
L’évolution du score ESSDAI, critère principal d’évaluation, dans le groupe systémique est représentée à la figure 3. On observe dans les 2 phases de l’étude une diminution numériquement plus importante du score ESSDAI sous DAZ vs PBO. Dans le groupe symptomatique, il y a une diminution statistiquement significative du score ESSPRI, critère principal de jugement, sous DAZ vs PBO à J169. Au cours de la phase 2, le score ESSPRI des patients initialement traités par PBO et switchés pour DAZ rejoint celui de l’autre
groupe.
Figure 3. Évolution du score d’évaluation ESSDAI chez des patients atteints d’une maladie de Sjögren traités par dazodalibep ou placebo (phase 1), avec cross-over des traitements à J169 (phase 2) [Abstract 1636].
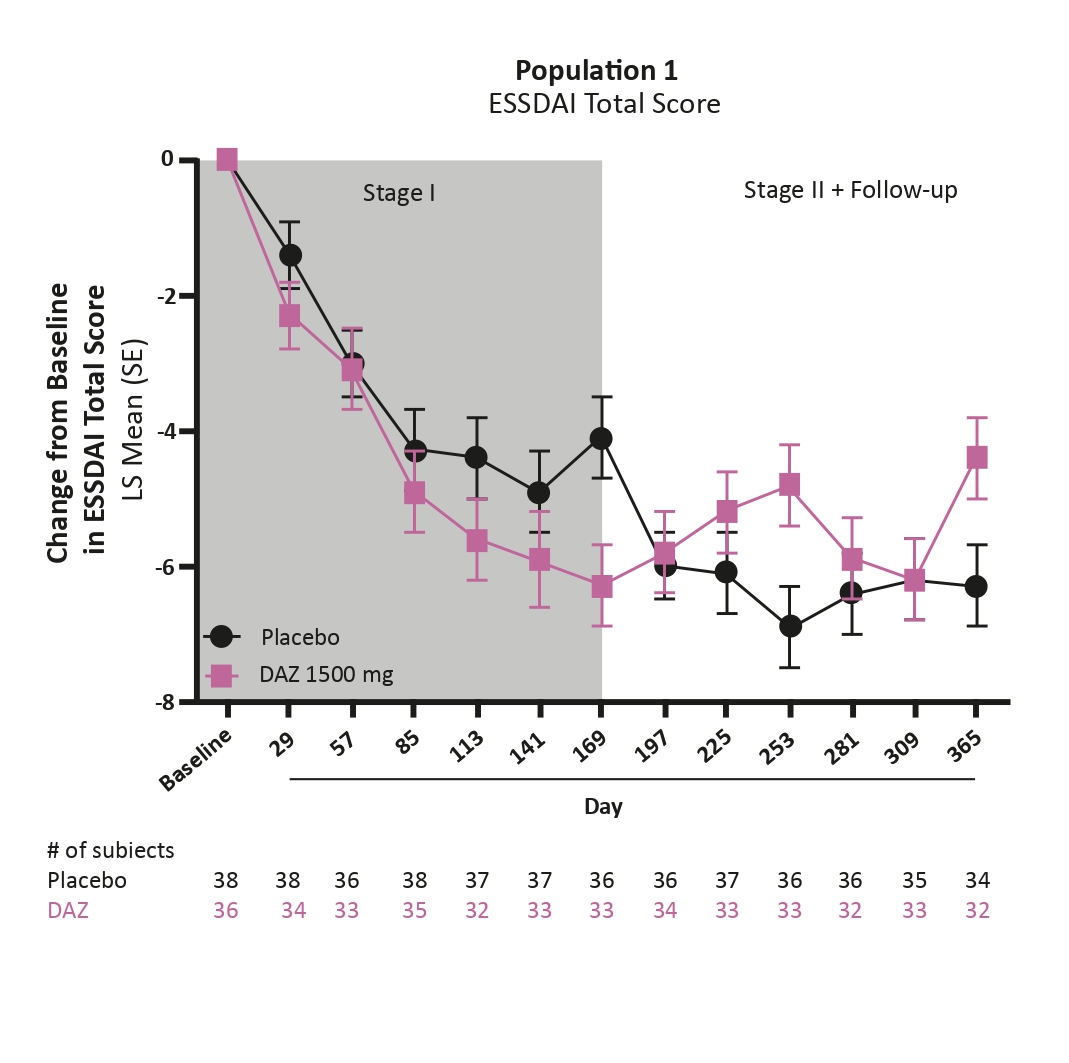
Les résultats de ces deux études montrent un effet favorable de l’inhibition du couple CD40-CD40L aussi bien dans la triade symptomatique que dans les atteintes systémiques de la maladie de Sjögren, ceci devant être confirmé et précisé (de même que la tolérance) dans des essais de phase 3. Une des grandes questions concernant les essais thérapeutiques (et le traitement en général) dans la maladie de Sjögren est celui de l’ancienneté de la maladie. On peut supposer, au vu de tout ce quenous connaissons dans les rhumatismes inflammatoires chroniques, que plus la maladie est récente, plus un traitement à visée immunologique sera efficace. ■
| L’auteur déclare ne pas avoir de lien d’intérêt. |


