CAS CLINIQUE
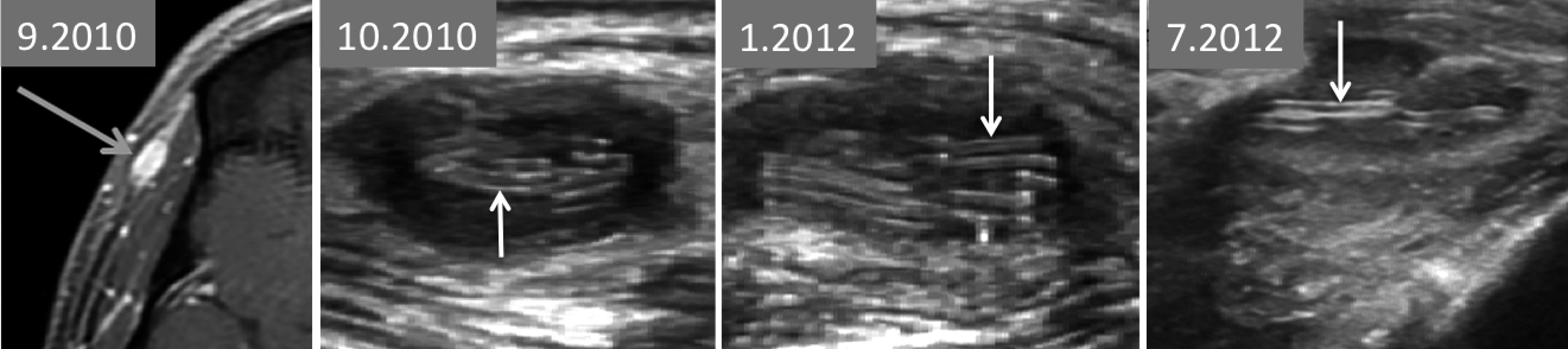
Un homme de 42 ans, italien vivant en Belgique, présente depuis 3 ans une tuméfaction nodulaire de la tempe droite, quasiment asymptomatique. Dans ses antécédents, on relève des voyages en Egypte quelques temps avant l’apparition de la lésion. C’est une tuméfaction ferme, d’environ 1 cm de diamètre pour 5 mm d’épaisseur, de volume parfois variable selon le patient. Cette lésion a déjà fait l’objet de plusieurs examens d’imagerie, dont plusieurs échographies montrant de curieuses structures linéaires pouvant faire évoquer des corps étrangers (compresse chirurgicale par exemple) (figure 1). Mais cet homme ne présente aucun antécédent local chirurgical ou autre.
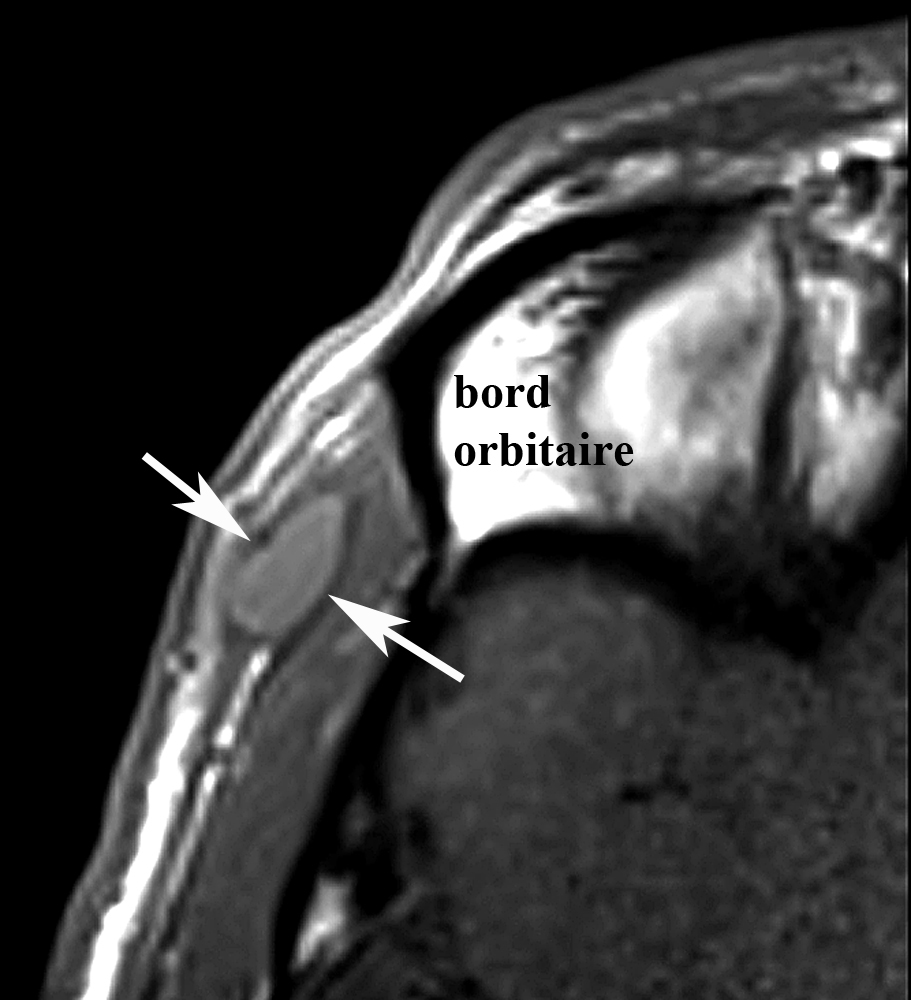
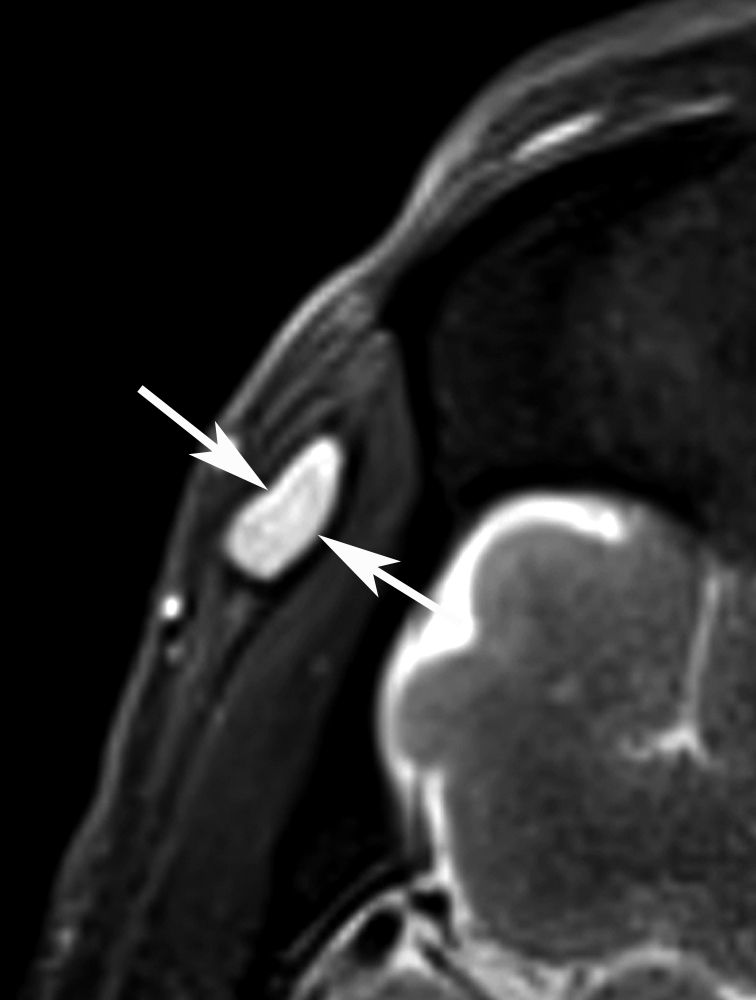
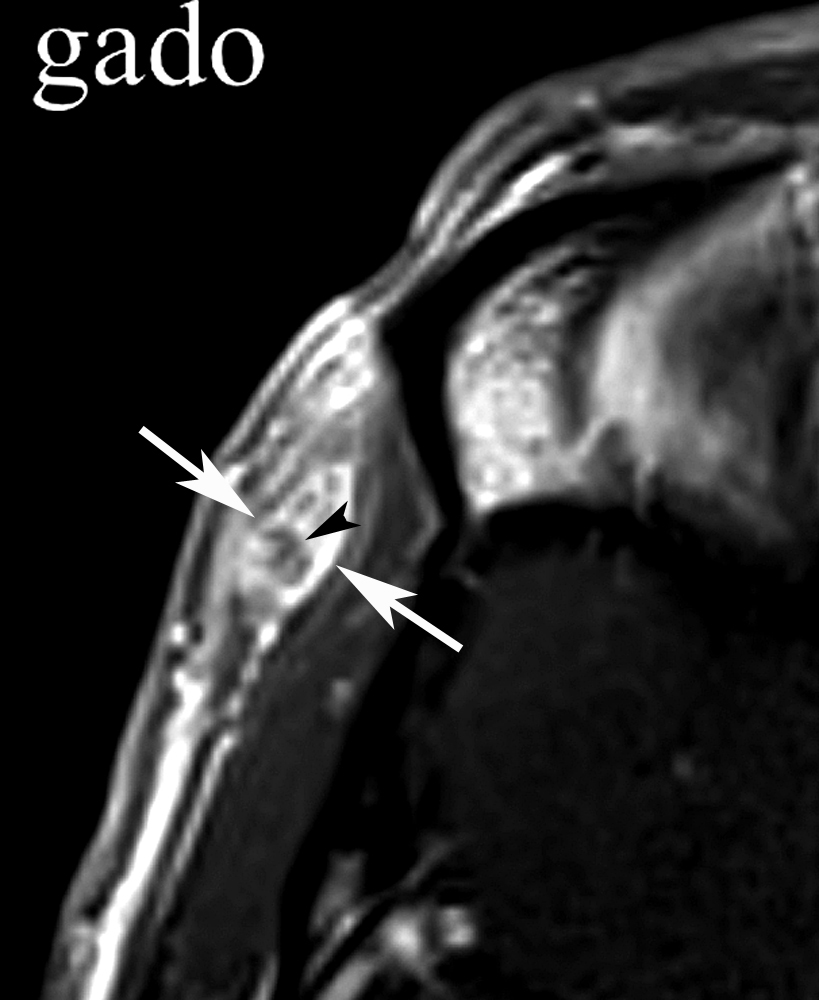
Il est en bon état général. Il n’a pas syndrome inflammatoire. La sérologie est négative pour divers parasites. Un traitement antihelminthique a déjà été prescrit, sans résultat. Après décision d’exérèse, un nouveau bilan d’imagerie est réalisé. L’IRM (figure 2) montre une petite masse hypodermique profonde, en signal faible en T1, relativement élevé en T2 et nettement rehaussante en T1 avec gadolinium.
| Figure 1. Examens précédemment réalisés de la région temporale. A : Une IRM en 9.2010, en pondération T1, avec contraste montre une petite formation hypodermique en signal intense correspondant à du tissu vascularisé (flèche). B à D : Des échographies réalisées à trois reprises, respectivement en 10.2010, 1.2012 et 7.2012, montrent l’aspect globalement hypoéchogène des lésions, contenant chaque fois de curieuses fines structures échogènes « en rails » (flèches). |
| Figure 2. Nouvelle IRM réalisée en 9.2012.La formation lenticulaire située dans le plan hypodermique profond de la région temporale (flèches) présente un signal faible à intermédiaire en pondération T1 (a), avec un rehaussement de signal avec contraste (b) et un signal intense en T2 avec saturation de la graisse (c). Notez le caractère hétérogène de la portion centrale de la masse, qui comporte de petites plages non rehaussantes (tête de flèche noire en b). |
 |
 |
 |
|
Figure 3. Nouvelle échographie. |
 |
 |
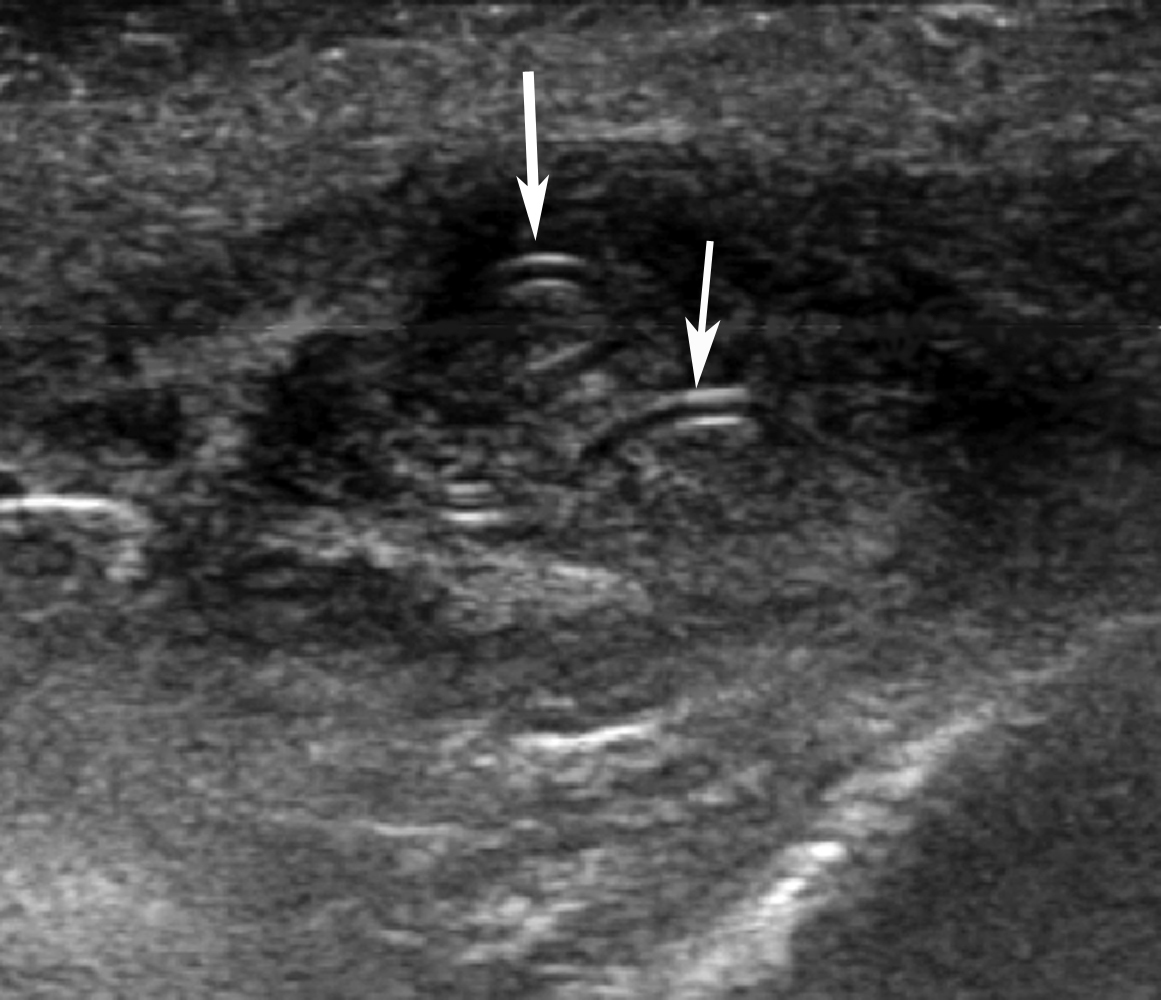 |
| Figure 4. Images extraite d’une courte vidéo. Après un temps prolongé (11 min), des coupes échographiques, réalisées avec la sonde immobile et quasi tangentielle au plan cutané, ont pu voir se déplacer et puis disparaître certaines des structures échogènes (flèches en a, b et c), résultant de leur mobilité spontanée. |
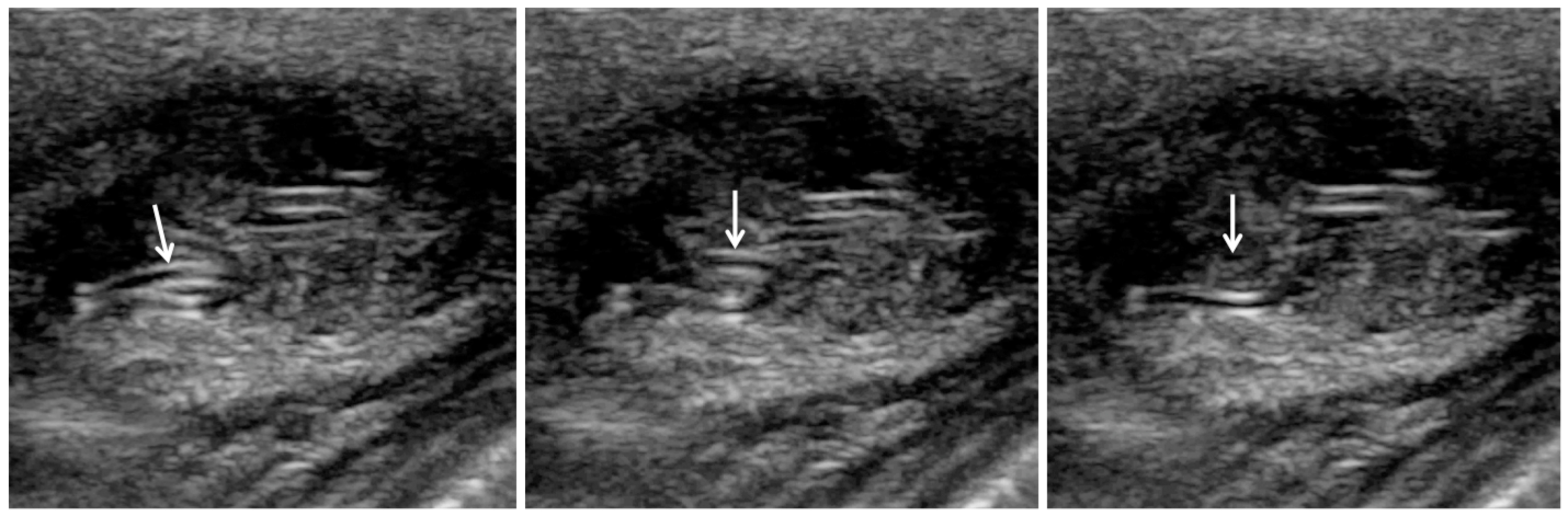
Une nouvelle échographie (figure 3) montre un contenu modérément hypoéchogène, comportant des signaux en Doppler couleur et de nombreuses structures échogènes linéaires d’aspect dédoublé, d’épaisseurs de l’ordre de 0,6 mm. La longueur de ces structures « en rails » apparaît très variée. Elles sont soit allongées soit quasi punctiformes, suggérant des structures tubulaires vues plus ou moins longitudinalement ou transversalement coupes réalisées dans un plan quasi « horizontal » (proche d’un plan parallèle au plan cutané) montrent que ces structures linéaires comportent des segments courbes (figure 3c). Au cours de la réalisation de ces images échographiques, plus de 10 minutes après le début de l’examen, les structures tubulaires ont présenté des mouvements ondulants spontanés, très suggestifs d’un parasite vivant (figure 4).
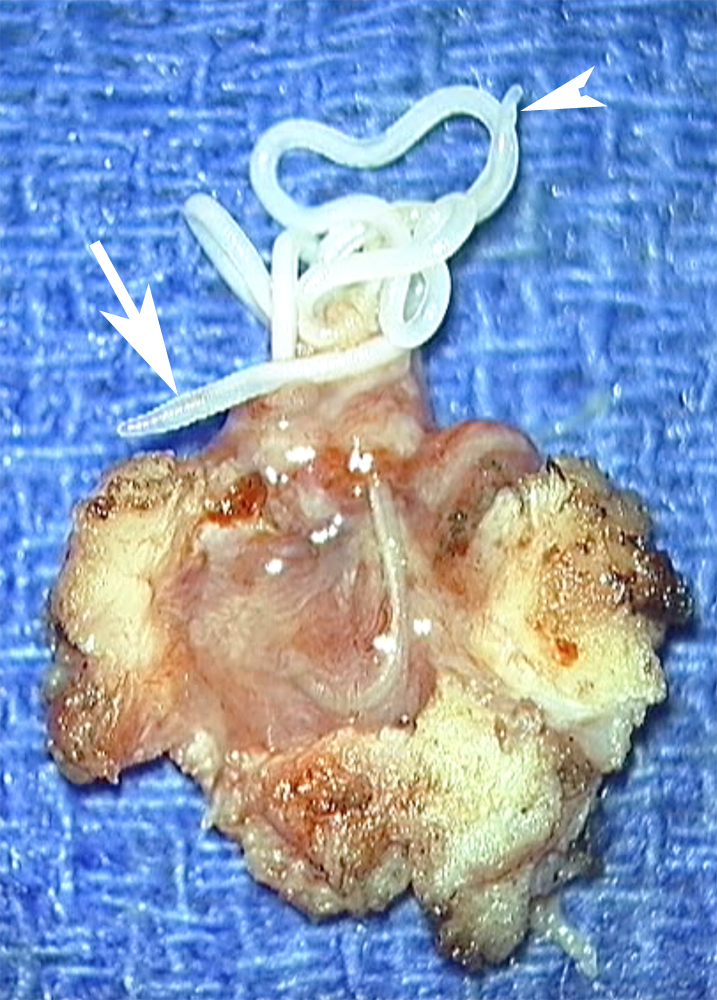
| Figure 5. Vue de la pièce d’exérèse chirurgicale. De la masse tissulaire, on voit sortir, à travers une brèche, une structure filiforme blanchâtre dont des portions sont mobiles (flèches en a, b et c et têtes de flèches en c et d). Notez de fines crêtes visibles en c (flèche). |
 |
 |
 |
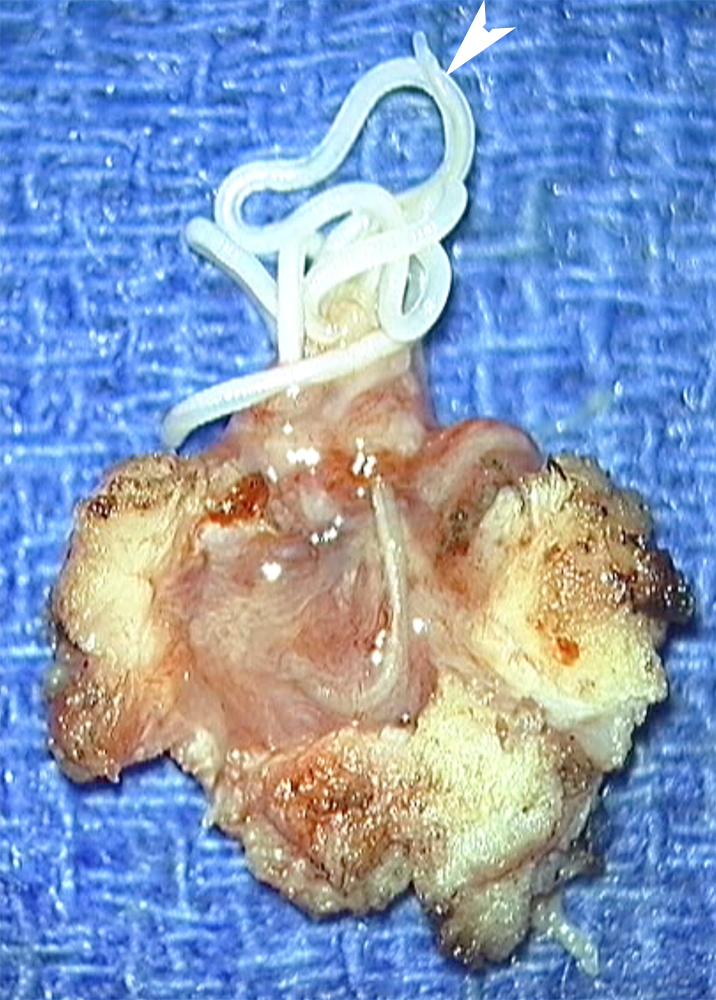 |
L’exérèse chirurgicale du nodule a visualisé lors de son ouverture la présence d’un long ver d’aspect blanchâtre (figure 5), mobile spontanément, long de 12 cm, correspondant aux descriptions de Dirofilaria repens. L’évolution ultérieure a été très favorable.
►MALADIE ANIMALE ET HUMAINE
La dirofilariose est une parasitose d’animaux carnivores sauvages ou domestiques, en particulier de chiens (réservoir principal) et plus rarement de chats. La contamination humaine est plus anecdotique1.
La transmission du parasite est faite par des moustiques, dont les espèces varient selon les régions (surtout Aedes, Culex, Anophèles). Des microfilaires sont sucées dans le sang de l’animal infecté par un moustique qui, après développement des larves, les transmet par piqûre également dans un nouvel hôte1,2,3.
Il y a plusieurs dizaines de variétés de Dirofilaria, mais les plus importantes par leur caractère pathogène sont les variétés immitis et repens dont les cibles sont différentes. Pour l’espèce Dirofilaria immitis, les localisations finales sont surtout le poumon et le coeur. C’est une maladie grave pour le chien, qui peut être mortelle, tandis que chez l’homme, dont la contamination est beaucoup plus rare, l’atteinte est généralement asymptomatique.
Pour l’espèce Dirofilaria repens, la plus fréquente chez l’homme, les localisations sont essentiellement hypodermiques1,4. Les lésions se développent dans le tissu hypodermique n’importe où, à proximité du site de piqûre. Les sites les plus fréquents sont la région de la tête dans près de la moitié des cas, en particulier la région oculaire qui en représente un tiers environ1,3,5,6.
L’homme constitue une impasse pour le parasite car il n’y atteint généralement pas la maturité sexuelle adulte et meurt après 2 à 8 ans. Si le parasite atteint la maturité, il n’est généralement pas fécondé. En effet, pour qu’une reproduction se produise, il faut qu'un nombre suffisant de piqûres de moustiques libèrent suffisamment de larves, qu’elles réussissent à atteindre la maturité et puissent se rencontrer et s’accoupler. Une microfilarémie est donc exceptionnelle3,4,5,7.
►ÉPIDÉMIOLOGIE
En 2012, un nombre de 1 782 cas de dirofilariose humaine étaient connus dans le monde, dont plus de 1 410 cutanées ou oculaires et moins de 372 pulmonaires8.
Dirofilaria immitis prédomine en Amérique, surtout aux Etats-Unis, ainsi qu’au Japon8. Dans l’Ancien Monde, ce sont les cas de Dirifilaria repens qui dominent très largement2,3,9. Avant l’année 2000, la plupart des cas étaient observés dans les régions méditerranéennes. Dans les années suivantes les cas méditerranéens ont encore augmenté, mais d’autres cas sont aussi apparus en Europe centrale et de l’est et l’incidence s’étend actuellement vers l’Europe du nord (nord de la France, Allemagne, Angleterre…)2,3,5,6,8,10.
►SYMPTÔMES, BIOLOGIE, TRAITEMENT
Le parasite, un seul le plus souvent, se développe en quelques semaines. Après une réaction tissulaire inflammatoire initiale parfois prurigineuse ou s’accompagnant de sensations de brûlures, se forme un nodule hypodermique d’un à trois cm de diamètre, ferme, rarement douloureux4. Le diagnostic différentiel généralement envisagé est celui des petites tumeurs et pseudotumeurs hypodermiques (lipome, kyste épidermoïde…). De rares cas de migration du nodule ont été décrits5. En cas de localisation oculaire superficielle, la mobilité du parasite peut être observée de façon directe11.
La biologie est peu contributive. En raison de l’absence de dissémination sanguine, il n’y a le plus souvent pas d’hyperéosinophilie, pas de syndrome inflammatoire, pas de sérologie positive. Des descriptions de microfilaires dans du matériel d’aspiration ou de prélèvement sanguin ont été très rarement rapportées3,4,5,7,12.
Le traitement est essentiellement chirurgical, habituellement sans nécessité de traitement antiparasitaire1,3. Certains préconisent cependant de compléter le traitement chirurgical par un traitement antiparasitaire si des microfilaires sont trouvés dans le ver adulte ou en cas de récidive4,13. Mais ces traitements additionnels n’ont pas fait clairement la preuve de leur efficacité et la chimiothérapie n’est généralement pas recommandée8.
►ANATOMIE PATHOLOGIQUE
Classiquement, le diagnostic formel nécessite la mise en évidence du parasite. Le nodule contenant le parasite est constitué par une formation fibreuse, associée à du tissu inflammatoire modéré (polynucléaires neutrophiles, quelques cellules géantes, lymphocytes) ou parfois plus intense en cas de nécrose suppurative3,13.
L’identification de l’espèce repose sur l’analyse du diamètre, de la musculature périphérique et de la cuticule. La filaire Dirofilaria repens est la plus grosse de l’espèce (220-660 microns, avec un diamètre plus grand pour la femelle). Sa longueur est de l’ordre de 10 cm7,11,14. La cuticule
a une surface ornée de crêtes transversales et longitudinales (figure 5c), ce qui donne un aspect festonné sur des coupes transversales, à l’inverse de la surface totalement lisse de la Dirofilaria immitis1. En-dessous se trouvent une couche musculaire, un tube digestif etdeux tubes génitaux. Si la filaire est morte, l’identification devient difficile3,5.
De nouvelles techniques de biologie moléculaire sont actuellement utilisables avec amplification et extraction par PCR (polymerase chain reaction) permettant d’obtenir in vitro de nombreux fragments d’ADN, et elles sont très spécifiques4,8. Une étude par exemple a montré que Dirofilaria immitis pouvait être responsable en Ukraine de plus de 10 % des atteintes oculaires, contrairement à l’opinion habituelle15.
►IMAGERIE
L’imagerie des pseudotumeurs à Dirofilaria repens n’a été que peu décrite (29 publications dans le site de recherche Pubmed en 2023).
En TDM avec contraste intraveineux, la lésion présente l’aspect d’une formation kystique entourée d’une paroi de densité rehaussée12,13.
En IRM, la lésion correspond à une masse tissulaire de signal faible en pondération T1, intermédiaire en T2 et rehaussant surtout en périphérie en T1 avec contraste14,16. C’est très peu spécifique.
En échographie, l’aspect peut être plus suggestif, en objectivant une masse hypoéchogène contenant des structures linéaires échogènes dédoublées en plus de signaux en Doppler couleur3,7. Ces images linéaires doubles « en rail » sont expliquées par la visualisation des deux parois réverbérantes du parasite de part et d’autre de leur contenu. Ces structures échogènes doubles apparaissent plus ou moins longues ou courtes, parfois quasi punctiformes, selon l’orientation de la sonde plus ou moins longitudinale ou transversale par rapport au parasite.
Mais ce qui est évidemment le plus spécifique en échographie, c’est la visualisation éventuelle de la mobilité du contenu des structures linéaires (figure 4), comme dans notre observation. Ces mobilités spontanées visibles en échographie ont également été décrites dans quelques publications3,14. À noter que la patience est de rigueur. Dans notre observation, les mouvements spontanés de ces structures linéaires n’ont été observés qu’après plus de 10 minutes d’examen !
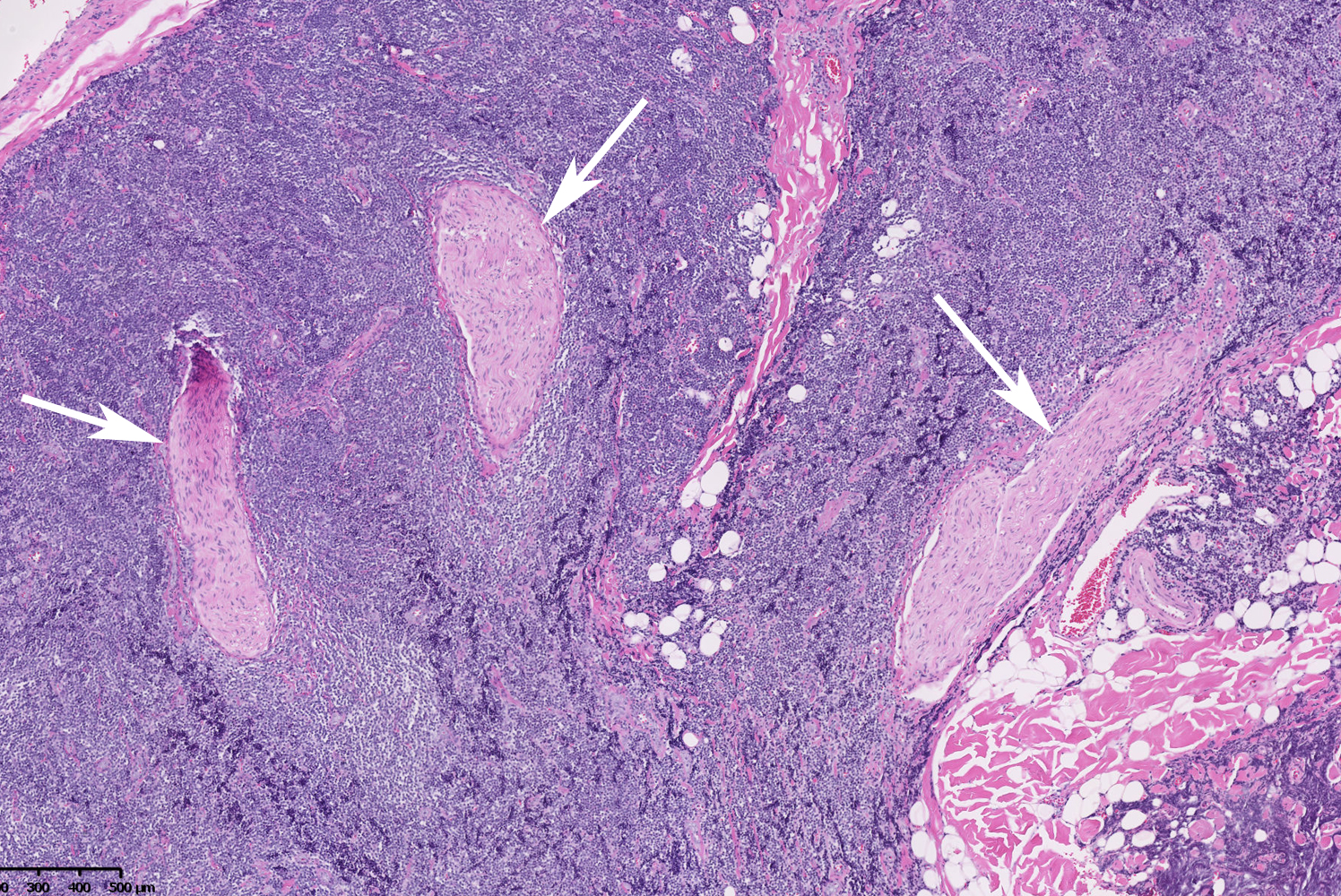
La mobilité des structures échogènes est la condition suffisante mais également nécessaire pour conclure formellement à la présence d’un parasite. D’autres images « en rails » peuvent être produites pas d’autres structures. Dans une autre circonstance, nous avons par exemple observé des structures « en rails » dans une large masse tissulaire (figure 6a). Mais elles étaient restées immobiles pendant plus d’une demi-heure. Cette lésion s’est avérée être un lymphome et les structures à parois hyperéchogènes par rapport à l’environnement correspondaient en histologie à des nerfs hypertrophiés (figure 6b).
►PERSPECTIVES
La transmission de Dirofilaria dépend de la présence -1- d’un minimum de chiens infectés contenant des vers adultes produisant des microfilaires et -2- de moustiques capables de les transmettre.
Une augmentation de l’incidence des cas peut résulter de facteurs sociologiques (nombre d’animaux porteurs et mouvements des populations) et d’une augmentation des insectes vecteurs. Cette augmentation peut être liée à des modifications de l’utilisation des insecticides par interdiction ou à l’inverse par développement de résistances en cas de surutilisation. Mais elle peut être surtout liée au réchauffement climatique car le développement de ces insectes nécessite une température de 14 degrés4,8,12.
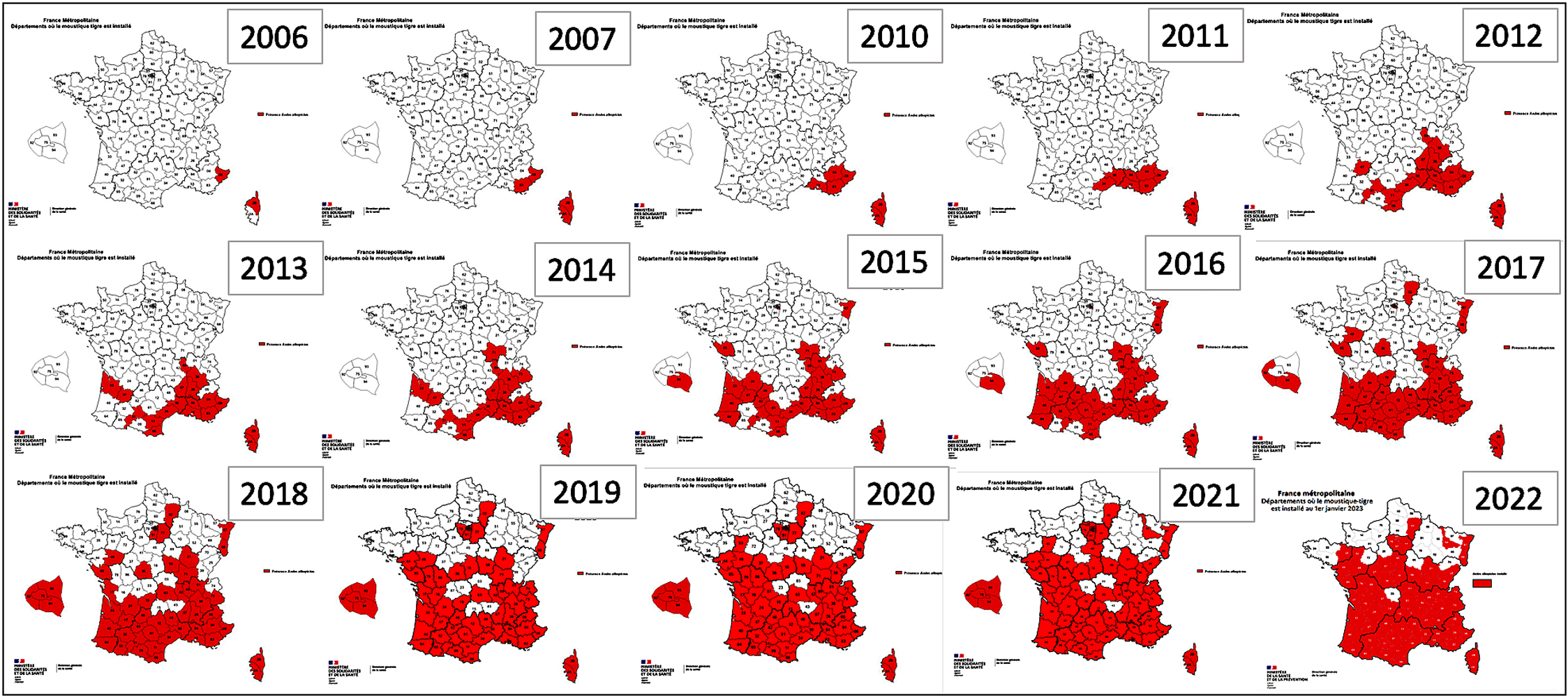
L’activité humaine, par le transport intercontinental de pneus usés contenant des nids à moustiques a introduit en Europe il y a quelques années un moustique asiatique (Aedes albopictus, dit « moustique tigre ») qui aurait un rôle très significatif dans la transmission croissante des dirofilaires en Europe9. Ce risque en augmentation est bien illustré par l’extension géographique en France de l’infestation par les moustiques tigres, extension
quasiment exponentielle (figure 7).
| Figure 6. Lymphome de la région pariétale. A : une échographie montre une structure échogène « en rails » (flèches), restée immobile durant un examen de plus d’une demi-heure. B : la recherche histologique dans la masse cellulaire de ce lymphome de structures linéaires à parois doubles et d’épaisseurs correspondant à celles de l’échographie, ne trouve que des nerfs hypertrophiés à parois épaissies (flèches) (document L. Marot et P. Van Eeckhout). |
 |
 |
| Figure 7. Moustique « tigre ». A : son aspect ; B. illustration de son territoire occupé en France au cours des dernières années, de 2006 à 2022, montrant son extension quasi exponentielle du sud vers le nord. (documents Ministère des solidarités et de la santé). |
 |
 |
| En résumé |
| Les pseudotumeurs à Dirofilaria repens sont actuellement une pathologie plutôt rare et encore peu connue. Mais qui est en nette augmentation ces dernières années et sa distribution géographique en Europe s’étend vers le Nord. On peut y songer en présence d’images échographiques « en rails » … et avoir la patience d’attendre le bon vouloir de la bestiole, dont la mobilité constitue l’élément diagnostique le plus absolu. |
RÉFÉRENCES : ◆1.Basset D, Sauguet P. Dirofilaria et dirofilarioses. Revue Francophone des Laboratoires 2016; 483: 37-44◆2.Genchi C, Kramer LH, Rivasi F. Dirofilarial infections in Europe. Vector Borne Zoonotic Dis. 2011; 11:1307-17.◆3.de Boysson H, Duhamel C, Heuzé-Lecornu L, Bonhomme J, de La Blanchardière A. Human dirofilariasis: a new French case of Dirofilaria repens. Rev Med Interne. 2012;33:e19-e21◆4.Benzaquen M, Marmottant E, Parola P, Berbis P. La dirofilariose cutanée. AnnDermatol Venereol. 2017;144:607-611.◆5.Cordonnier C, Chatelain D, Nevez G, Sevestre H, Gontier MF, Raccurt CP. Problèmes soulevés par le diagnostic de la dirofilariose humaine à distance de la zone enzootique connue. Rev Med Interne. 2002 Jan;23:71-6.◆6.Marty P. Human dirofilariasis due to Dirofilaria repens in France. A review of reported cases. Parassitologia. 1997;39:383-6.◆7.Estran C, Marty P, Blanc V, Faure O, Leccia MT, Pelloux H, Diebolt E, Ambrosetti D, Cardot-Leccia N. Dirofilariose humaine : 3 cas autochtones dans le sud de la France. Presse Med. 2007;36:799-803. ◆8.Simón F, Siles-Lucas M, Morchón R, et al. Human and animal dirofilariasis: the emergence of a zoonotic mosaic. Clin Microbiol Rev. 2012;25:507-44.◆9.Simón F, Morchón R, González-Miguel J, Marcos-Atxutegi C, Siles-Lucas M.What is new about animal and human dirofilariosis? Trends Parasitol. 2009;25:404-9.◆10.Raccurt CP. La dirofilariose humaine en France : nouvelles données confirmant la transmission humaine de Dirofilaria Repens au nord de la latitude 46°nord. Med Trop. 2000;60:308-9.◆11.Khoramnia R, Wegner A. Images in clinical medicine: Subconjunctival Dirofilaria repens. N Engl J Med. 2010;363:25.◆12.Fournier G. Morquin D. Goulabchand R. Tingaud C. M. de Boutray B.Dirofilariose autochtone intra-musculaire temporale. Médecine et maladies infectieuses. 2018; 48:424-26.◆13.GheorghiŢă MI, ForŢofoiu MC, Dumitrescu CI, Dumitrescu D, et al. Intramuscular human Dirofilaria repens infection of the temporal region - case report and review of the literature. Rom J Morphol Embryol. 2017;58:585-592.◆14.Gopinath TN, Lakshmi KP, Shaji PC, Rajalakshmi PC. Periorbital dirofilariasis clinical and imaging findings: live worm on ultrasound. Indian J Ophthalmol. 2013;61:298-300.◆15.Rossi A, Peix Á, Pavlikovskaya T, et al. Genetic diversity of Dirofilaria spp. isolated from subcutaneous and ocular lesions of human patients in Ukraine. Acta Trop. 2015;142:1-4.◆16.Groell R, Ranner G, Uggowitzer MM, Braun H AJNR Orbital dirofilariasis: MR findings Am J Neuroradiol. 1999;20:285-6.


