| 1ère partie |
FRACTURES SOUS-CHONDRALES PAR INSUFFISANCE SIMPLES (SIF) OU AVEC OSTÉONÉCROSE (SIF-ON)
Il y a dans la littérature d'énormes confusions de terminologie. Certains auteurs utilisent le terme d'ostéonécrose spontanée (SONK pour Spontaneous Osteonecrosis of the Knee) indifféremment pour des lésions transitoires et pour celles qui se compliquent de collapsus1,2 mais d’autres utilisent le terme de fracture par insuffisance (SIF pour Subchondral Insuffi ciency Fracture of the Knee) à la fois pour celles qui guérissent et celles qui évoluent vers un collapsus nécrotique3,5. C’est aussi l’avis actuel des experts de l’International Skeletal Society qui proposent que le terme SONK soit carrément abandonné et remplacé systématiquement par celui de SIF6,7.
Cependant, comme ces lésions ont, en pratique, des significations cliniques différentes, nous proposons de garder la terminologie SIF pour les fractures sous-chondrales par insuffisance simple et de préciser SIF-ON pour celles qui se compliquent d’ostéonécrose (Figure 1).
NB : D’autres entités peuvent entrer dans le diagnostic différentiel (nécroses systémiques, oedème des syndromes douloureux chroniques de type 1, chondropathies profondes) et seront traitées dans une deuxième partie.
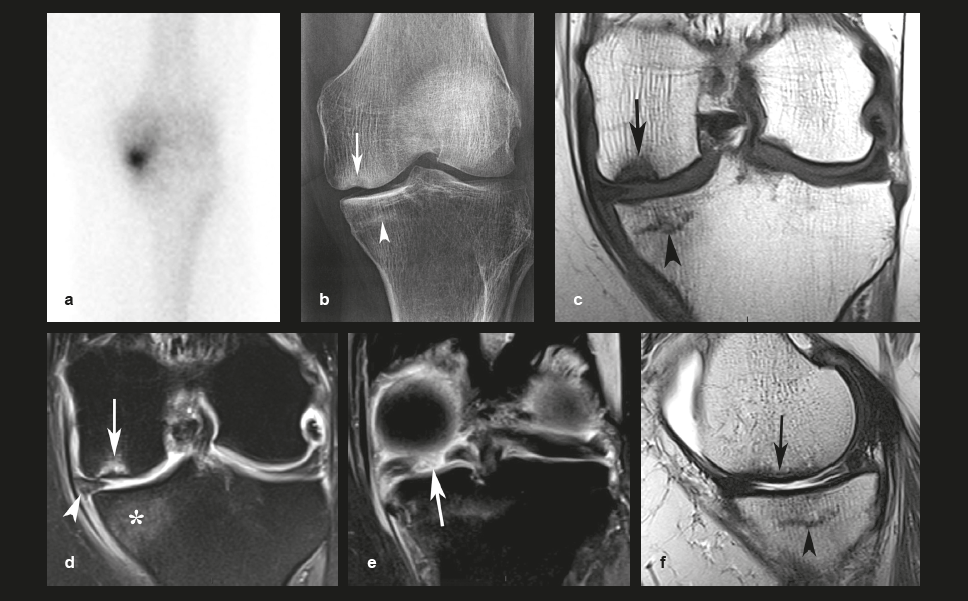
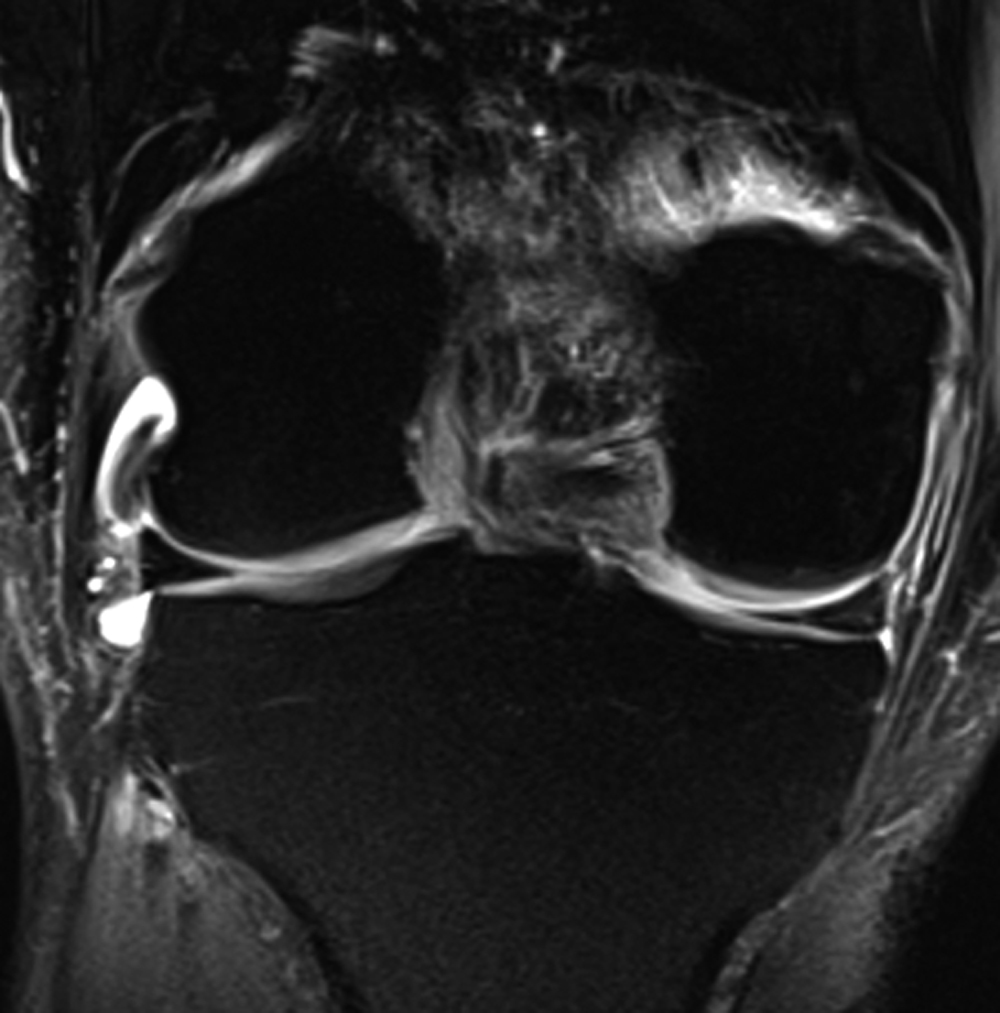
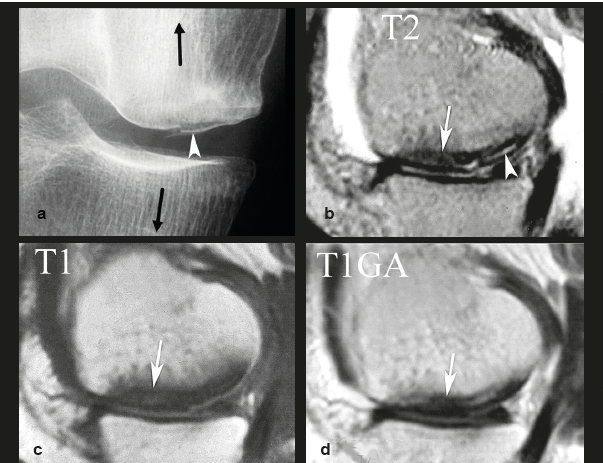
| Figure 1. Fracture sous chondrale par insuffisance (SIF) et fracture par insuffisance avec nécrose (SIF-ON). a : chez une femme de 68 ans, la scintigraphie révèle une hypercaptation intense dans le compartiment fémoro-tibial médial. Deux mois plus tard, la radiographie (b) montre un collapsus focal du pôle inférieur du condyle médial (flèche) avec densification hétérogène de l’os spongieux adjacent, et une bande horizontale densifiée parallèle au plateau tibial médial (tête de flèche). L’IRM en pondération T1 (c) montre un hyposignal focal très marqué dans le pôle inférieur du condyle médial (flèche) et une fine strie horizontale en hyposignal sous le plateau tibial médial (tête de flèche). En T2 avec saturation du signal de la graisse (T2FS) (d), la lésion du condyle présente un signal très hétérogène (flèche) et le territoire sous le plateau tibial un discret hypersignal médullaire (astérisque). e : Une coupe coronale plus postérieure montre une rupture radiaire de la corne postérieure du ménisque médial (flèche) largement séparée, responsable d'une extrusion de la portion moyenne de ce ménisque (tête de flèche en d). f : une coupe sagittale en T2 montre une couche épaisse et étendue en hyposignal bordant la surface sous-chondrale du pôle inférieur du condyle (flèche), correspondant à un territoire de moelle osseuse dégradée. Sous le plateau tibial, la finestrie horizontale en hyposignal (tête de flèche) est entourée d'un signal médullaire pratiquement homogène. Ces aspects sont typiques d’une SIF simple pour le plateau tibial et d’une SIF-ON avec ostéonécrose pour le condyle (voir plus loin). |
▶UN PEU D'HISTOIRE
Les collapsus épiphysaires spontanés (« nécroses dites spontanées ») ont été décrits en 1968 sur base radiologique8.
Avec l'IRM, ces lésions sont aussi reconnues par la mise en évidence d'un aspect d'oedème de la moelle osseuse et certains ont appliqué le terme d'ostéonécrose spontanée du genou (SONK) à toute douleur d'apparition spontanée associée, en territoire sous-chondral, à un foyer de type oedémateux en IRM ou à une hypercaptation scintigraphique9-11.
Mais, au vu de la guérison naturelle de certaines de ces lésions, d'autres auteurs ont noté que les éléments communs entre des oedèmes spontanés transitoires et ceux avec collapsus nécrotique permettent d'envisager une étiologie unique12-19.
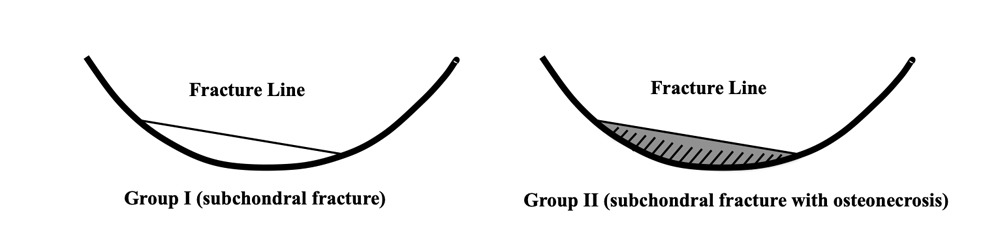
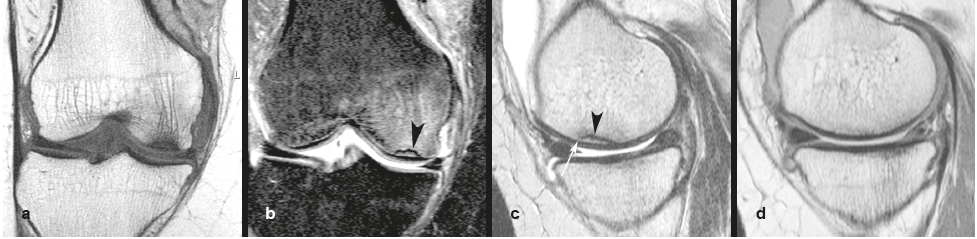
Yamamoto et Bullough en 2000 ont largement fait avancer le schmilblick. Ces auteurs ont relu le matériel histologique de lésions diagnostiquées comme ostéonécroses spontanées du genou. Ils ont noté en histologie deux types de lésions : 1) celles dont la ligne fracturaire sous-chondrale est bordée de tissu de réparation mais pas de nécrose et 2) celles qui comportent une zone de nécrose entre la ligne fracturaire et la surface articulaire. Ils en concluent que la fracture est probablement l'événement primaire et la nécrose éventuelle un événement secondaire20 (Figure 2).
|
Figure 2. Schéma illustrant la classification histopathologique des deux types de lésions sous-chondrales, par Yamamoto et Bullough (avec autorisation de l'auteur T.Y.20). Dans les lésions auparavant considérées comme « ostéonécrose spontanée du genou (SONK) », les auteurs ont montré que la zone située entre le trait de fracture et le contour articulaire contient soit de la moelle osseuse normale (correspondant aux SIF simples), soit de l’ostéonécrose (correspondant aux SIF-ON). |
▶CONTEXTE NOSOLOGIQUE
Ces lésions surviennent chez des sujets âgés (moyenne d'âge de 60 ans ou plus) avec une nette prépondérance féminine, sans contexte métabolique ou thérapeutique particulier3,8,21-23. Un terrain d'ostéopénie est établi dans certaines études, mais pas toutes24-25. Des fractures par insuffisance particulièrement larges ou nombreuses se rencontrent cependant dans des cas de fragilité osseuse évidente chez des transplantés rénaux15 ou en cas d'ostéomalacie26 (Figure 3).
Le début des symptômes est brutal dans près de trois quarts des cas. Il peut survenir suite à un traumatisme ou un simple faux mouvement. Le sujet se souvient fréquemment de son activité précise à ce moment.
| Figure 3. SIF chez un patient souffrant d’ostéomalacie. La coupe en IRM pondérée T2 montre une bande en hyposignal correspondant à une fracture trabéculaire particulièrement épaisse (flèche). L’environnement médullaire est de signal relativement élevé, de type oedémateux (astérisque) y compris entre la fracture et la surface articulaire (têtes de flèches). |
Les lésions sont les plus fréquentes dans le condyle fémoral médial (65 %) et portent sur le pôle inférieur dans la zone d'appui12,22,25. Les localisations dans le condyle latéral représentent environ 15 %, ainsi que les localisations sur le plateau tibial médial27.
L'association à une chondrose varie considérablement selon les séries, d’un cartilage intact à une chondrose sévère4,7,25.
L'association à une lésion méniscale est vraiment très élevée21, en particulier, à une rupture radiaire de la corne postérieure du ménisque médial ou de son attache dans plus de 50 % des cas21,23 (Figure 1d). Ce type de rupture déstabilise en effet le ménisque, augmentant la pression sur les surfaces articulaires de plus de 25 %28. Des SIF et des SIF-ON peuvent aussi survenir après méniscectomie21,29,30,31 (Figure 4).
| Figure 4. Décompensation osseuse après méniscectomie. a : chez une femme de 72 ans, l’arthroscanner montre une rupture du corps méniscal médial avec un petit fragment dans l’échancrure intercondylienne (flèches). Après méniscectomie, 10 mois plus tard, une IRM en T1 (b) montre un hyposignal très marqué dans le pôle inférieur du condyle médial (flèche) et une discrète dépression de la surface sous-chondrale (tête de flèche). Une coupe en T2FS (c) montre un remaniement osseux sous-chondral étendu avec des plages d'aspect géodique en signal intense (flèches). |
▶ASPECT RADIOLOGIQUE
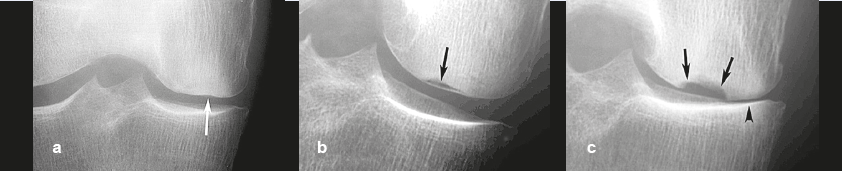
Pour les SIF non compliquées, les radiographies sont normales (stade 1) ou montrent des anomalies très subtiles : plage hypodense en territoire sous-chondral et/ou parfois discret aplatissement de la convexité du condyle (stade 2)20 (Figure 5). En cas de SIF avec ostéonécrose (SIF-ON), le territoire collabé devient hétérogène et entouré d’un halo de densification (stade 3) (Figure 1b). À ce stade, la surface sous-chondrale peut présenter des signes de fracture « macroscopique » pathognomonique comme pour les nécroses systémiques : enfoncement focal avec décrochement du contour ou séparation de la lame osseuse sous-chondrale restée solidaire du cartilage (dissection sous-chondrale « en coquille d'oeuf ») (Figure 6). Ces anomalies peuvent être vues sur des clichés tangents au segment suspect, éventuellement réalisés en traction ouvrant la séparation souschondrale (Figure 7a et 7b). Tardivement, des modifications arthrosiques secondaires apparaissent (stade 4) (Figure 7c)20.
| Figure 5. Stade précoce d’une SIF. a : la radiographie est d’aspect quasi normal, avec un aplatissement à minima de la surface du condyle (tête de flèche). L’IRM en pondération T1 (b) montre un hyposignal global modéré du condyle (astérisque) prédominant à proximité de la surface articulaire. Une coupe en T2FS (c) montre une infiltration de type oedémateux en hypersignal s’étendant sans limite précise à une partie plus ou moins importante du condyle (astérisque), plus intense à proximité de la surface articulaire. Notez que la fi ne strie fracturaire en hyposignal est mal visible en pondération T1 et qu’en T2FS elle est bordée de part et d’autre par l'hypersignal intense de l’oedème médullaire, qui s’étend donc à l’espace entre la fracture et la lame osseuse sous-chondrale (têtes de flèches). Le signal intense de ce territoire sous-chondral est un signe très important pour différencier une SIF d’une SIF-ON. |
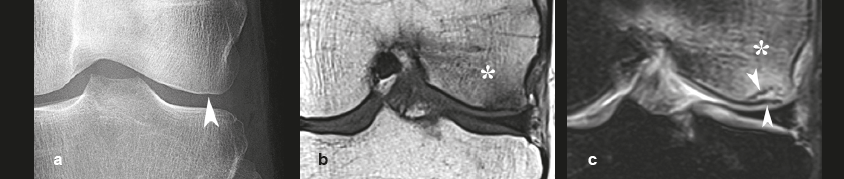
| Figure 6. Aspect radiologique d'une fracture sous-chondrale « mobile », pathognomonique de nécrose. a : sur la coupe d'un arthroscanner, une fine fracture/séparation dans l’os trabéculaire sous-chondral apparaît sous l’aspect d’une très fine strie radiotransparente (« dissection en coquille d’oeuf ») (flèche). b : quelques mois plus tard, une radiographie montre un collapsus discret du pôle inférieur du condyle (flèche) avec un remaniement osseux hétérogène adjacent et des ruptures dans la continuité de l’os sous-chondral (têtes de flèches). c : un cliché complémentaire réalisé en scopie et en traction montre une légère ouverture de la dissection osseuse sous-chondrale (flèche). |
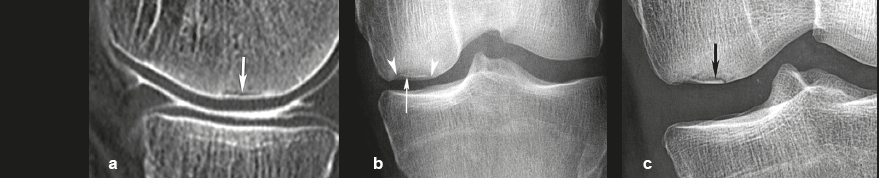
| Figure 7. Évolution d’une fracture sous-chondrale avec ostéonécrose débutante. a : la radiographie objective une très discrète densification de l'os spongieux au voisinage d'une minime dépression du pôle inférieur du condyle (flèche). b : un cliché additionnel tangent au versant postéro-inférieur du condyle, réalisé en traction, objective une dissection sous-chondrale typique (flèche) démontrant formellement l’ostéonécrose sous-chondrale. c : trois mois plus tard, ce territoire nécrosé présente un collapsus avec décrochement du contour épiphysaire (flèches), déjà compliqué d’un pincement complet de l’interligne cartilagineux (tête de flèche). |
▶ASPECT EN IRM
Aspect d'oedème médullaire
Le signe cardinal est l’aspect oedémateux de la moelle osseuse sous-chondrale. Mais c’est un signe aspécifique.
En réalité, en histologie un oedème médullaire est rarement observé et les altérations du signal décrites en IRM sont dues à des remaniements variés : dilatations vasculaires, hémorragies interstitielles, infiltrations cellulaires, tissu de granulation, formation decals, nécrose et fibrose dépendant de l’étiologie32. En imagerie, il est donc recommandé d'éviter les termes « oedème » ou « signal oedémateux » au profit d’un « aspect d’oedème » ou « signal de type oedémateux »6,7.
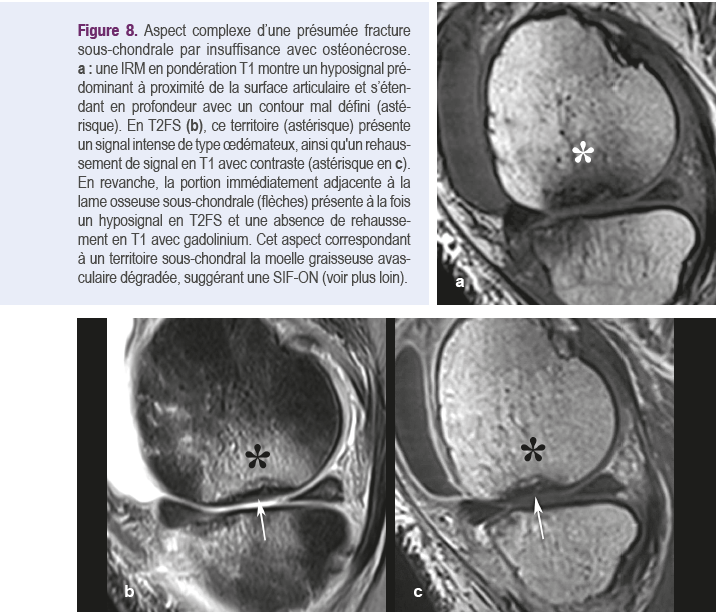
Cet aspect d'oedème se réfère à une zone mal définie de moelle osseuse qui présente une réduction du signal graisseux en pondération T1 et une augmentation du signal en pondération T2, nettement plus intense avec saturation du signal de la graisse ( T2 « fat sat » ou « T2FS »), ainsi qu’avec d’autres séquences sensibles aux liquides (STIR, DPFS, Dixon T2 "Water"…), que nous désignerons aussi par simplification en « T2FS ». Avec l'injection intraveineuse de gadolinium, le signal en T1 devient également intense (Figure 8)5,19,35.
En cas de SIF, l'infiltration prédomine à proximité de la surface épiphysaire et s'étend en dégradé dans l’épiphyse. L'extension de l'infiltration n'a pas en soi de signification pronostique 21.
L'infiltration peut s'accompagner d'une fine ligne en signal très intense en T2FS immédiatement adjacente à la lame osseuse sous-chondrale, probablement liée à une hyperémie dans ce territoire richement vascularisé33. En cas de SIF, cet aspect est présent dans plus de la moitié des cas, surtout en phase aiguë (< 3 mois) ou subaiguë (3-6 mois)34. Un aspect oedémateux des tissus mous adjacents peut également être observé dans la grande majorité des SIF d'un condyle fémoral27 (Figure 9).
Très important, en cas de SIF le signal médullaire de type oedémateux présente des bords mal définis, contrairement aux ostéonécroses d’origine systémique où les lésions sont entourées d’un liseré de sclérose périphérique en hyposignal17,18,23,35.
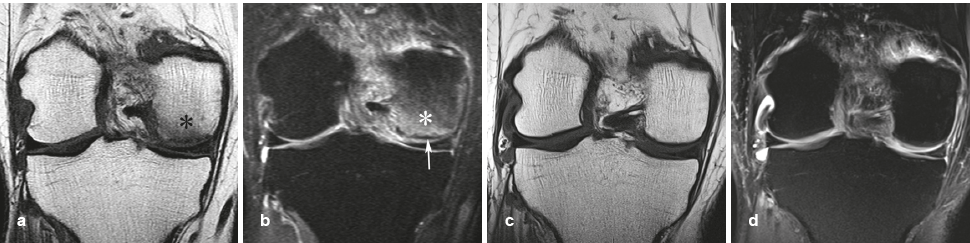
| Figure 9. Autres particularités de l’aspect d’oedème. En cas d’infiltration médullaire de type oedémateux intense, le territoire immédiatement adjacent à la lame osseuse sous-chondrale peut présenter en pondération T2FS un hypersignal finement linéaire très intense (têtes de flèche), qui pourrait être lié à une hyperémie de ce territoire richement vascularisé. L’aspect d’oedème intense peut aussi porter sur les tissus mous adjacents (flèche). |
Visibilité de la fracture et son rôle pathogène éventuel
Quand elle est visible, la fracture sous-chondrale a l'aspect d'une fine ligne en hyposignal sur toutes les séquences, située à faible distance de la surface articulaire. Elle est mieux visible avec les séquences sensibles aux liquides car en pondération T1 elle peut être masquée par l’hyposignal de l'infiltration médullaire adjacente.
Très important, en cas de SIF non compliquée, l'aspect d'oedème est présent de part et d'autre de la ligne fracturaire, y compris donc entre la fracture et la surface sous-chondrale (Figure 10) .
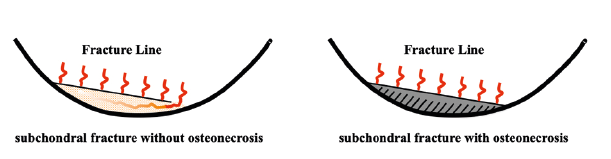
Le fait que la fracture isole complètement ou non la zone sous-chondrale peut être une hypothèse pathogénique expliquant la différence entre SIF simple et SIF-ON (Figure 11). Une fracture isolant complètement une zone sous-chondrale pourrait en effet compromettre sa vascularisation, tandis qu’en cas de continuité persistante, la vascularisation préservée permet la survie tissulaire (Figures 10 c et d). L'apport vasculaire sous-chondral du
condyle semble en effet résulter d'un réseau d'artérioles terminales anastomosées bien illustré dans une étude36.
Il faut donc regarder dans plusieurs plans les coupes pour déterminer si le plan fracturaire isole complètement ou incomplètement le territoire sous-chondral situé entre la fracture et la surface articulaire (Figure 10 b et c). C'est probablement un élément déterminant dans l’évolution vers la nécrose ou vers la guérison. Mais même en cas de communication persistante, il se peut qu'il n'y ait pas suffisamment de flux sanguin résiduel si la zone isolée est trop grande.
Évolution vers la guérison
En cas de SIF, un traitement conservateur permet généralement une diminution satisfaisante des douleurs et une guérison sans séquelle et avec un signal médullaire normalisé en quelques mois (Figure 10 d).
Le traitement proposé est généralement basé sur une mise en décharge relative pendant une période de 6 semaines, par exemple par l'aide de béquilles, suivi d'une remise en charge très progressive à l'aide de cannes. Une physiothérapie peut aider à éviter l'atrophie musculaire. Un traitement adjuvant par bisphosphonates est proposé par certains37,38.
|
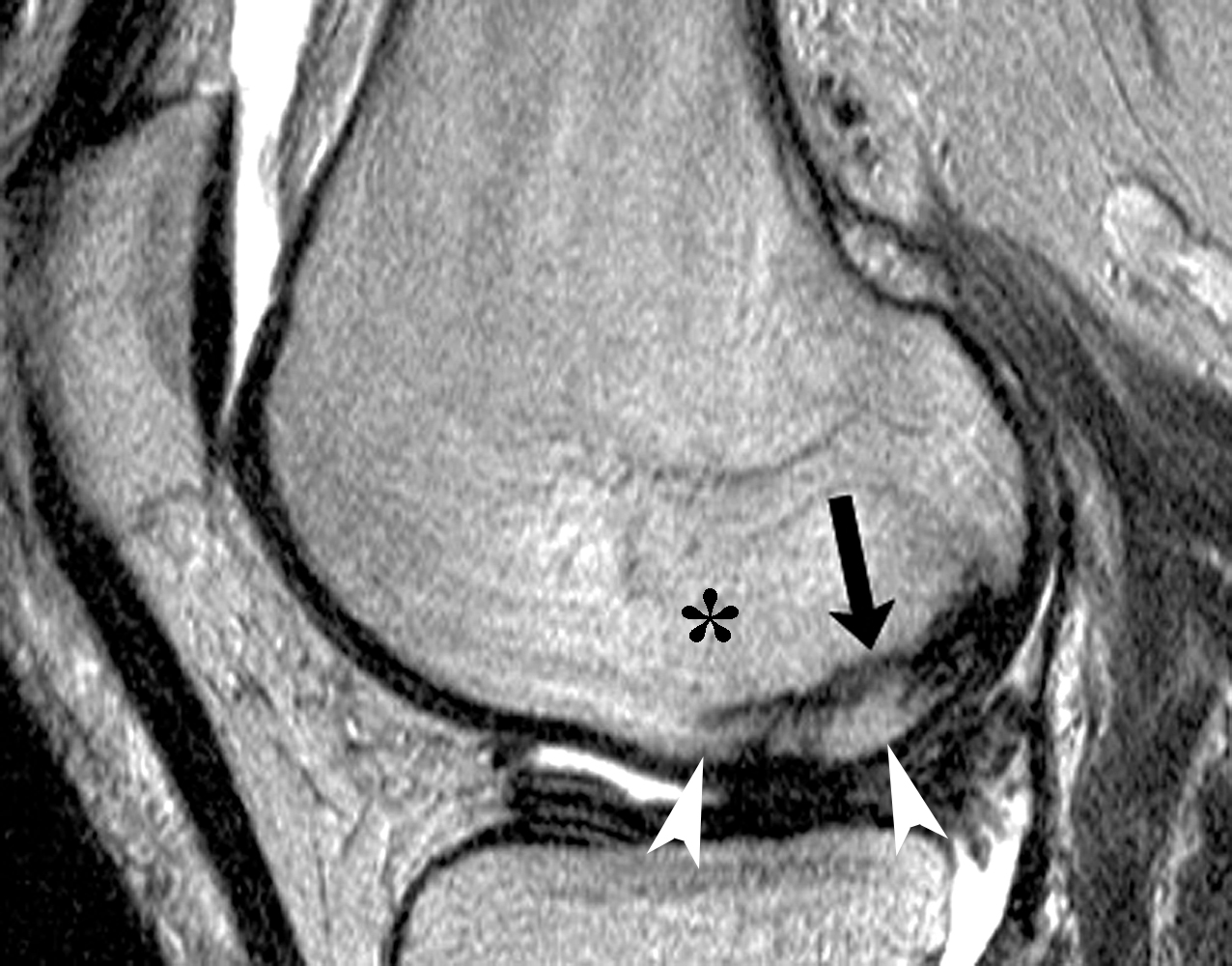
Figure 10. Aspect d’une fracture sous-chondrale par insuffisance (SIF) dans une zone de moelle osseuse d’aspect oedémateux. En pondération T1 (a), la fracture peut être masquée par l’hyposignal de voisinage, tandis qu'en T2FS (b) ou T2 (c) elle est visible (têtes de flèches) par contraste avec l'environnement en signal intense. Dans ce cas de SIF simple, le signal de type oedémateux est présent de part et d'autre de la fracture, y compris dans l'espace entre celle-ci et la surface articulaire, correspondant dans ce territoire à une moelle graisseuse infiltrée mais non dégradée. Notez que la strie fracturaire n’isole pas complètement cet espace sous-chondral, car persiste une communication avec l'espace médullaire épiphysaire global (fine flèche blanche en c). Le potentiel de guérison de cette SIF a été confi rmé par un contrôle quelques mois plus tard montrant une normalisation (d). |
| Figure 11. Schéma de Yamamoto et Bullough modifié. Le schéma original (Figure 2) a été modifié pour proposer qu’une SIF puisse garder un potentiel de guérison si le territoire situé entre le plan fracturaire et la surface articulaire conserve une continuité avec l'espace médullaire global de l’épiphyse. À l’inverse, une SIF-ON se produirait si cette continuité est perdue. |
En cas de SIF-ON
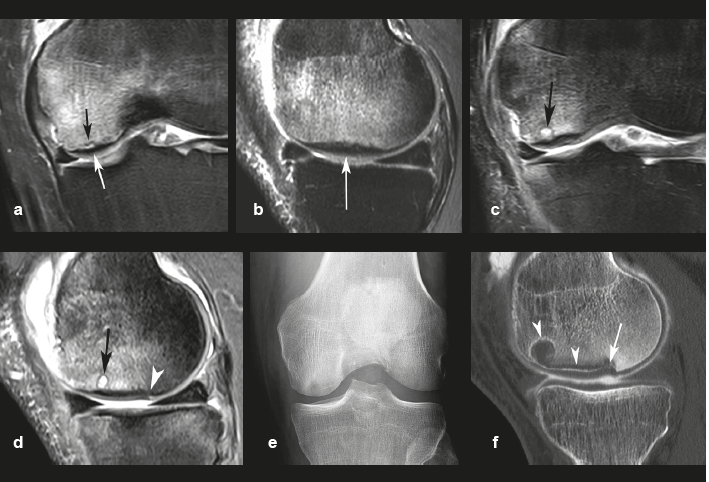
Un collapsus marqué de la surface articulaire signe la décompensation d'une SIF. L’os sous-chondral se désorganise et présente des remaniements variés. Tardivement, la fracture sous-chondrale peut évoluer en fracture trans-chondrale, pouvant libérer des fragments de la surface articulaire (Figure 12).
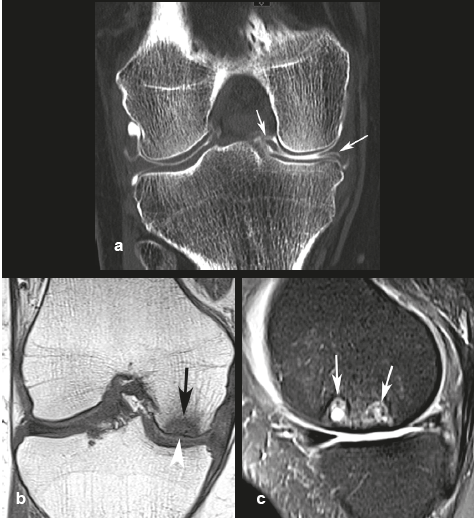
| Figure 12. Exemple d’évolution péjorative d’une SIF vers une SIF-ON. a, b : au stade initial, l’aspect d’oedème épiphysaire en signal intense en T2FS et une petite image fissuraire (flèche noire en a) sont à première vue peu différents de ceux d’une SIF. Cependant, le territoire sous-chondral adjacent au cartilage comporte une couche médullaire épaisse et étendue en hyposignal (flèches blanches en a et b). Cinq mois plus tard (c, d) des anomalies médullaires persistent, avec apparition de petites images d’allure géodique (flèches) et d'une petite rupture du contour de l’os sous-chondral (tête de flèche en d). A nouveau trois mois plus tard (e, f), la radiographie montre encore une densification hétérogène du pôle inférieur du condyle et un arthroscanner une géode sous-chondrale et une résorption osseuse (têtes de flèches), associées à un collapsus focal de la surface souschondrale (flèche). |
Avant même le stade de fracture macroscopique, la moelle osseuse nécrosée adjacente à l'os sous-chondral peut présenter un hyposignal en pondération T211,17,18,33,39-42. Cet hyposignal correspond histologiquement à de la graisse médullaire dégradée, « saponifiée », solidifiée42. Cette zone nécrosée ne présente pas non plus de rehaussement de signal en T1 avec contraste17,35,41(Figure 13).
| Figure 13. SIF-ON avec collapsus sous-chondral. Une radiographie réalisée en traction en valgus (flèches a) montre une dissection de l’os sous chondral (tête de flèche). Une image IRM pondérée en T2 montre une large zone sous-chondrale de faible intensité de signal (flèche en b). Sur les images pondérées T1 sans (c) et après injection de contraste (d) une grande partie de cette zone en hyposignal T2 ne se rehausse pas non plus en T1 après injection de contraste (flèche en d). Notez aussi la fi ne ligne en signal intense de type liquidien en T2 dans les zones de dissection sous-chondrale (têtes de flèches en b). |
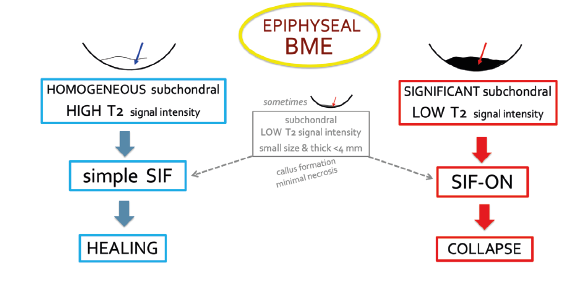
Valeur pronostique de l'hyposignal médullaire en T2 (ou T1 avec contraste)
La valeur pronostique péjorative de l'hyposignal médullaire en T2 a été décrite dès 199011. Des couches médullaires sous-chondrales en hyposignal T2 d’épaisseur supérieure à 4 mm ou de longueur supérieure à 14 mm correspondent à des lésions irréversibles (SIFON) (sensibilités/spécificités de l'ordre de 100 et 80 % pour l'épaisseur et de 90 % et 90 % pour la longueur) (Figure 14) 17,18. Des valeurs similaires sont observées pour les plages médullaires de plus de 3 cm² non rehaussantes avec contraste35. Les autres facteurs de mauvais pronostic sont une déformation nette de la surface articulaire et la présence de lignes fracturaires à distance de la surface18 (Figure 15). À l’inverse, une couche sous-chondrale en hyposignal
T2 d’épaisseur inférieure à 2 mm est généralement indicative d’une lésion réversible17,18. La fine couche de graisse médullaire en hyposignal T2 dans ce cas, peut correspondre à du tissu de granulation et de réparation.
En cas d'épaisseur "limite", entre 2 à 4 mm, la lésion doit être considérée comme de pronostic incertain et faire l’objet de contrôles à moyen terme (Figure 16).
Ne soyons pas simplistes. Ces règles pronostiques n’ont pas une signification absolue. Rien n’empêche qu’une SIF non compliquée initialement ne décompense ultérieurement, spontanément ou suite à une méniscectomie déstabilisante.
La valeur pronostique du signal en T2 est résumée dans la Figure 17.
Évolution tardive des lésions
La survenue de complications secondaires peut dépendre de facteurs multiples : poids du patient, degré d'ostéopénie, précocité du traitement, importance de la chondropathie, degré d'extrusion méniscale hors de l’interligne articulaire...1,4,27.
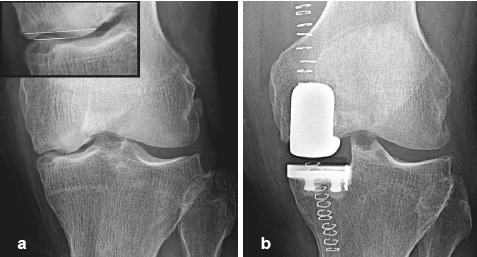
L'évolution péjorative du collapsus est évidemment liée à la taille de la lésion. Par exemple, le pronostic est défavorable quand la zone de nécrose est de largeur supérieure à 40- 50 % de celle du condyle (Figure 18) ou que sa surface est supérieure à 5 cm², tandis que des collapsus de petite taille peuvent se stabiliser spontanément14,22,25 (Figure 19).
| Figure 16. Epaisseur « limite » de l’hyposignal de la moelle osseuse sous-chondrale en T2. Une IRM montre, dans le condyle fémoral médial, une infiltration de type oedémateux en hyposignal en T1 (a) et hypersignal en T2FS (b) dans le condyle fémoral médial (astérisques). Immédiatement contre la surface sous-chondrale, la coupe en T2FS montre une très fine couche tissulaire en hyposignal (flèche en b) d’épaisseur « limite ». Dans le cas présent, le suivi à 3 mois (c et d) a montré la guérison, avec normalisation du signal du pôle inférieur du condyle. |
| Figure 17. Schéma résumant la valeur pronostique de l'intensité du signal sous-chondral typique sur les séquences pondérées T2 en cas de SIF et SIF-ON. Notez que dans certains cas, une zone souschondrale très limitée en hyposignal en T2 est de pronostic douteux et peut progresser soit vers la guérison, soit en SIF-ON. Sans événement particulier (méniscectomie ou dégénérescence rapide du cartilage par exemple), une évolution d'une SIF typique en SIF-ON est très rare. |
| Figure 18. Évolution d’une SIF-ON en fonction de la dimension de la nécrose. La radiographie montre un collapsus du pôle inférieur d’un condyle, qui s’étend à plus de 50 % de sa largeur (64 %). Son évolution péjorative a amené à la mise en place d’une prothèse quelques mois plus tard (b). |
| Figure 19. Évolution d’une SIF-ON en cas de petite dimension de la nécrose. Une coupe coronale en IRM en T2FS (a) et une coupe sagittale en T2 (b) montrent un territoire de signal sous-chondral hétérogène de très petite dimension (têtes de flèches) inférieure à 50 % de la largeur du condyle. Dix mois plus tard, des coupes coronale et sagittale d’un arthroscanner (c, d) montrent la stabilité de ce collapsus très limité (flèches). |

| CONCLUSION |
| Les fractures par insuffisance des surfaces du genou, simples (SIF) ou compliquées d'ostéonécrose (SIF-ON) constituent une entité étiologique commune, mais avec des cliniques et des modifications différentes en imagerie. La reconnaissance de ces différences, en particulier la présence dans l’espace sous-chondral d’un aspect d’oedème ou d’un hyposignal en T2 peut permettre de présumer précocement de l’évolution ultérieure des lésions. |
| Les auteurs déclarent ne pas avoir de lien d’intérêt. |
RÉFÉRENCES
♦1. Hatanaka H, Yamamoto T, Motomura G et al. Histopathologic findings of spontaneous osteonecrosis of the knee at an early stage: a case report. Skeletal
Radiol. 2016;45:713-6.♦2. Young JR, Shamrock AG, Rosenbaum AJ. Spontaneous Osteonecrosis of the Knee. 2021 Jul 10. In: StatPearls [Internet]. Treasure
Island (FL): StatPearls Publishing; 2022 Jan–.♦3. Hussain ZB, Chahla J, Mandelbaum BR et al. The Role of Meniscal Tears in Spontaneous Osteonecrosis of the
Knee: A Systematic Review of Suspected Etiology and a Call to Revisit Nomenclature. Am J Sports Med. 2019;47:501-507.♦4. Sayyid S, Younan Y, Sharma G et al.
Subchondral insuffi ciency fracture of the knee: grading, risk factors, and outcome. Skeletal Radiol. 2019;48:1961-1974.♦5. Maraghelli D, Brandi ML, Matucci Cerinic
M et al. Edema-like marrow signal intensity: a narrative review with a pictorial essay. Skeletal Radiol. 2021;50:645-663.♦6. . Gorbachova T, Amber I, Beckmann NM
et al. Nomenclature of Subchondral Nonneoplastic Bone Lesions. AJR Am J Roentgenol. 2019;213:963-982.♦7. Palmer W, Bancroft L, Bonar F. Glossary of terms
for musculoskeletal radiology. Skeletal Radiol. 2020;49 (Suppl 1):1-33.♦8. Ahlbäck S, Bauer GCH, Bohne WH. Spontaneous osteonecrosis of the knee. Arthritis
Rheum 1968; 11: 705-733.♦9. Greyson ND, Lotem MM, Gross AE et al. Radionuclide evaluation of spontaneous femoral osteonecrosis. Radiology. 1982;142:729-35.♦10. Houpt JB, Pritzker KP, Alpert B et al. Natural history of spontaneous osteonecrosis of the knee (SONK): a review. Semin Arthritis Rheum. 1983;13:212-27.♦11. Björkengren AG, AlRowaih A, Lindstrand A et al. Spontaneous osteonecrosis of the knee: value of MR imaging in determining prognosis. AJR Am J Roentgenol.
1990;154:331-6.♦12. Norman A, Baker ND. Spontaneous osteonecrosis of the knee and medial meniscal tears. Radiology 1978; 129:653-656.♦13. Hall FM.
Osteonecrosis of the knee and medial meniscal tears. Radiology. 1979;133(3 Pt 1):828-9.♦14. Lotke PA, Ecker ML. Osteonecrosis of the knee. J Bone Joint Surg Am.
1988;70:470-3.♦15. Vande Berg BC, Malghem J, Goffi n EJ et al. Transient epiphyseal lesions in renal transplant recipients: presumed insuffi ciency stress fractures.
Radiology. 1994;191:403-7.♦16. Lafforgue P., Daumen-Legré V., Clairet D. et al. Les fractures par insuffisance osseuse du condyle fémoral interne. Rev Rhum
1996; 63:287-294.♦17. Malghem J, Le Hir P, Lecouvet F et al. Ostéonécrose du genou. In : Le genou traumatique et dégénératif. GETROA Opus XXIV Sauramps
Medical, Montpellier 1997, pp 117-136.♦18. Lecouvet FE, Vande Berg BC, Maldague BE et al. Early irreversible osteonecrosis versus transient lesions of the femoral
condyles: prognostic value of subchondral bone and marrow changes on MR imaging. AJR Am J Roentgenol. 1998;170:71-7.♦19. Le Gars L, Savy JM, Orcel P et al.
Le syndrome intituled “ostéonécrose du plateau tibial interne” peut être lié à une fracture de contrainte. Rev Rhum 1999; 66: 375-382.♦20. Yamamoto T, Bullough PG.
Spontaneous osteonecrosis of the knee: the result of subchondral insufficiency fracture. J Bone Joint Surg Am. 2000;82:858-66.♦21. Gorbachova T, Melenevsky Y,
Cohen M et al. Osteochondral Lesions of the Knee: Differentiating the Most Common Entities at MRI. Radiographics. 2018;38:1478-1495.♦22. Aglietti P, Insall JN,
Buzzi R et al. Idiopathic osteonecrosis of the knee. J Bone Joint Surg Br 1983; 65: 588-597.♦23. Yao L, Stanczak J, Boutin RD. Presumptive subarticular stress
reactions of the knee: MRI detection and association with meniscal tear patterns. Skeletal Radiol. 2004;33:260-4.♦24. Zanetti M, Romero J, Dambacher MA et al.
Osteonecrosis diagnosed on MR images of the knee. Relationship to reduced bone mineral density determined by high resolution peripheral quantitative CT. Acta
Radiol. 2003;44:525-31.♦25. Farrell TP, Deely DM, Zoga AC et al. Lateral femoral condyle insuffi ciency fractures: imaging findings, demographics, and analysis of
outcomes. Skeletal Radiol. 2021;50:189-199.♦26. Kobayashi H, Ito N, Akiyama T et al. Prevalence and clinical outcomes of hip fractures and subchondral insuffi ciency
fractures of the femoral head in patients with tumour-induced osteomalacia. Int Orthop. 2017;41:2597-2603.♦27. Wilmot AS, Ruutiainen AT, Bakhru PT. Subchondral
insuffi ciency fracture of the knee: A recognizable associated soft tissue edema pattern and a similar distribution among men and women. Eur J Radiol. 2016;85:2096-2103.♦28. Allaire R, Muriuki M, Gilbertson L et al. Biomechanical consequences of a tear of the posterior root of the medial meniscus. Similar to total meniscectomy.
J Bone Joint Surg Am. 2008;90:1922-31.29. Brahme SK, Fox JM, Ferkel RD et al. Osteonecrosis of the knee after arthroscopic surgery: diagnosis with MR imaging.
Radiology. 1991;178:851-3.♦30. Johnson TC, Evans JA, Gilley JA et al. Osteonecrosis of the knee after arthroscopic surgery for meniscal tears and chondral lesions.
Arthroscopy. 2000;16:254-61.♦31. MacDessi SJ, Brophy RH, Bullough PG et al. Subchondral fracture following arthroscopic knee surgery. A series of eight cases.
J Bone Joint Surg Am. 2008; 90: 1007-12.♦32. Zanetti M, Bruder E, Romero J, Hodler J. Bone marrow edema pattern in osteoarthritic knees: correlation between
MR imaging and histologic fi ndings. Radiology. 2000 Jun;215(3):835-40.♦33. Vande Berg BC, Mourad C, Omoumi P, Malghem J (2023) Magnetic resonance
imaging of accelerated bone remodeling. Semin Musculoskelet Radiol 27:114–123.♦34. Gondim Teixeira PA, Balaj C, Marie B et al. Linear signal hyperintensity
adjacent to the subchondral bone plate at the knee on T2-weighted fat-saturated sequences: imaging aspects and association with structural lesions. Skeletal Radiol.
2014;43:1589-98.♦35. Le Hir P, Laredo JD, Zeitoun F et al. « Ostéonécrose » du condyle fémoral : le syndrome de contusion spontanée et l’ostéonécrose ischémique.
In Savoir faire en radiologie ostéo-articulaire. Sauramps Medical, Montpellier 2000, pp 135-149.♦36. . Reddy AS, Frederick RW. Evaluation of the intraosseous and
extraosseous blood supply to the distal femoral condyles. Am J Sports Med. 1998;26:415-9.♦37. Jordan RW, Aparajit P, Docker C et al. M. The importance of early
diagnosis in spontaneous osteonecrosis of the knee - A case series with six year follow-up. Knee. 2016;23:702-7.♦38. Bhatnagar N, Sharma S, Gautam VK et
al. Characteristics, management, and outcomes of spontaneous osteonecrosis of the knee in Indian population. Int Orthop. 2018;42:1499-1508. ♦39. Froberg PK,
Braunstein EM, Buckwalter KA. Osteoporosis, transient osteoporosis, and transient bone marrow edema: current concepts. Radiol Clin North Am 1996; 34: 273-291.♦40. Lecouvet FE, Malghem J, Maldague BE et al. MR imaging of epiphyseal lesions of the knee: current concepts, challenges, and controversies. Radiol ClinNorth Am. 2005;43:655-72, vii-viii.♦41. Ochi J, Nozaki T, Nimura A et al. Subchondral insuffi ciency fracture of the knee: review of current concepts and radiological
differential diagnoses. Jpn J Radiol. 2021 Nov 29.♦42. Vande Berg B, Malghem J, Labaisse MA et al. Avascular


